
| 组合序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ |
| 组合数据 |
分析 (1)①当n(C):n(H)=1:1时,最简单的烃应为乙炔;
②若是烃的含氧衍生物,当n(C):n(H)=1:1时,则最简单的有机物应为乙二醛;
(2)结合已知条件,令有机物组成为CnHnOm,可以得到如下关系:
CnHnOm +$\frac{5n-4m}{4}$O2 $\stackrel{点燃}{→}$n CO2 +$\frac{n}{2}$H2O
13n+16m $\frac{5n-4m}{4}$
W1 $\frac{V}{22.4}$
得关系式:$\frac{13n+16m}{W{\;}_{1}}$=$\frac{\frac{5n-4m}{4}}{\frac{V}{22.4}}$,当m=0时,即有机物不含有氧,得$\frac{13n}{{W}_{1}}=\frac{5V}{4×22.4}$,当n(C):n(H)=1:1时,有机物中碳原子数n≥2,据此判断;
当m>0时,即有机物含有氧,得$\frac{13n}{{W}_{1}}=\frac{5V}{4×22.4}$,建立的等式中只要含有m,且只要确定m是否等于零即可;有机物的质量减去有机物中碳、氢元素的质量即为有机物中含有氧元素的质量;
(3)结合已知条件,令有机物组成为CnHnOm,可以得到如下关系:
CnHnOm +$\frac{5n-4m}{4}$O2 $\stackrel{点燃}{→}$n CO2 +$\frac{n}{2}$H2O
13n+16m $\frac{5n-4m}{4}$ 44n 9n
W1 $\frac{V}{22.4}$ W2 W3
显然,建立的等式中只要含有m,且只要确定m是否等于零即可;
(4)n(C):n(H)=1:1的有机物在氧气不足时燃烧,CO、CO2和水蒸气的混合气体共3mol,根据碳元素和氢元素守恒可知,CO、CO2的总物质的量等于水的物质的量的2倍,运用极限假设法,若混合气体为CO和水蒸气,或为CO2和水蒸气,分别计算出剩余气体的物质的量,进而确定范围;
解答 解:(1)①当n(C):n(H)=1:1时,最简单的烃应为乙炔,其结构简式为CH≡CH,
故答案为:CH≡CH;
②若是烃的含氧衍生物,当n(C):n(H)=1:1时,则最简单的有机物应为乙二醛,其结构简式为OHCCHO,
故答案为:OHCCHO;
(2)若有机物中无氧原子,则m=0,m1与v之间满足的条件是:13n:W1 =$\frac{5n}{4}$:$\frac{V}{22.4}$,整理得W1=$\frac{13V}{28}$;
若有机物中含有氧,消耗相等体积的氧气需要有机物的质量减小,故此时W1<$\frac{13V}{28}$;m(CO2)=W2g,则有机物中m(C、H)=$\frac{W{\;}_{2}}{44}$×13g,所以有机物中m(O)=W1-$\frac{13W{\;}_{2}}{44}$,
故答案为:W1=$\frac{13V}{28}$;W1<$\frac{13V}{28}$;W1-$\frac{13W{\;}_{2}}{44}$;
(3)结合已知条件,令有机物组成为CnHnOm,可以得到如下关系:
CnHnOm +$\frac{5n-4m}{4}$O2 $\stackrel{点燃}{→}$n CO2 +$\frac{n}{2}$H2O
13n+16m $\frac{5n-4m}{4}$ 44n 9n
W1 $\frac{V}{22.4}$ W2 W3
显然,建立的等式中只要含有m,且只要确定m是否等于零即可,故尚需的数据有两个,其组合为:W1、V;W1、W2;W1、W3;V、W2;V、W3共5种,
故答案为:2;
| 组合序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ |
| 组合数据 | W1、V | W1、W2 | W1、W3 | V、W2 | V、W3 |
点评 本题属于开放性题目,试题能全方位考查学生的各种能力,体现新课程理念,在高考中经常出现,注意充分利用有机物燃烧通式减小解答,难度较大.把常规题目中的条件略作改动,使其条件过剩,或者条件缺乏,可形成较好的开放性试题.由于字母含义的不确定性,若将试题中的数据用字母代替,会使得解题思路呈现发散性,从而得到开放性试题.


科目:高中化学 来源: 题型:选择题
| A. | HCOOH | B. | HOOC-COOH | C. | HOCH2CH2COOH | D. | 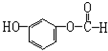 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
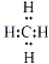 .
.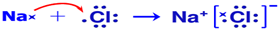
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/(L•min) | B. | 0.2mol/(L•min) | C. | 0.3mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

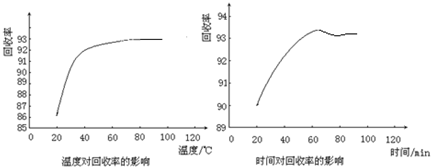
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
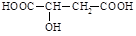 苹果酸是一种常见的有机酸,其结构简式如图.苹果酸可能发生的反应是( )
苹果酸是一种常见的有机酸,其结构简式如图.苹果酸可能发生的反应是( )| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
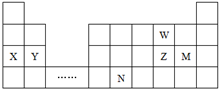
| A. | 离子半径:W2->Y2+ | |
| B. | 电解X与Z形成的化合物的水溶液,不能得到X单质 | |
| C. | 碘的氢化物酸性比M的氢化物酸性弱 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com