
��10�֣���ij�¶��¡��ݻ���Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��
2SO2��g����O2��g��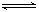 2SO3��g�� ��H����196kJ��mol��
2SO3��g�� ��H����196kJ��mol��
��ʼͶ����������ﵽƽ��ʱ���й��������£�
��1������ʼͶ��a molSO2��b molO2��c molSO3������ͬ�����£�Ҫ�ﵽ�����ͬ�Ļ�ѧƽ�⣬��a��c��Ӧ����Ĵ�����ϵʽΪ_________;b��c��Ӧ����Ĵ�����ϵʽΪ _________��
��2�����¶��´˷�Ӧ��ƽ�ⳣ��ֵΪ______________��������ͬ�¶���������ʼͶ�� 0��1molSO2��0��1molO2��0��3molSO3����Ӧ��ʼʱ���淴Ӧ���ʵĴ�С��ϵ�� _______
_______
��3�����������еķ�Ӧ�ֱ��ƽ��ʱ�������ݹ�ϵ��ȷ����_______________
| A����1����2��1 | B��Q1��Q2��196 |
| C����3<��1 | D��P3��2P1��2P2 |

��10�֣�
��1��a+c=2 ��1�֣� b+c/2="1" ��1�֣�
(2) 80 ��2�֣� < ��2�֣�
��3�� ABD ��2�֣���ѡ����ѡ�����÷֣���ѡ��1�֣�
��4�������¶Ȼ����������2�֣���д����һ������2�֣�
����
��1���ں��¡����������£����ڷ�Ӧǰ������������ı�Ŀ��淴Ӧ���ı���ʼʱ�������ʵ����ʵ�����ͨ����ѧ���������㣬��Ͷ�����������ԭͶ����ͬһ�����ʵ����ʵ���������������ֵ��ȣ�����ƽ���Ч�����һ�Ϊ��Чƽ�⡣a+c=2��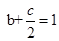
��2��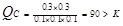 ��ƽ�������ƶ���
��ƽ�������ƶ���
��3�����һ�Ϊ��Чƽ�⣬һ��������ʼ��һ��������ʼ�����մﵽ��ȫͬ��ƽ��״̬��AB��ȷ��
���൱��������ȫͬ�ļף�����ͬ���¶��£���ѹѹ��һ����������ʱƽ�⽫�������ƶ���Q3��2Q1 ��P3��2P1��2P2��
��4�������¶Ȼ��������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | A | B |
| ��Ӧ��Ͷ���� | 1mol CO2��g����3mol H2��g�� | 1mol CH3OH��g����1mol H2O��g�� |
| CH3OH��g��Ũ�ȣ�mol?L-1�� | c1 | c2 |
| ��Ӧ�����仯 | �ų�29.4kJ | ����akJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?����һģ����ij�¶��¡��ݻ���Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��2SO2��g��+O2��g��
��2011?����һģ����ij�¶��¡��ݻ���Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��2SO2��g��+O2��g�� 2SO3��g����H=-196kJ/mol����ʼͶ�����������ƽ��ʱ���й��������£�
2SO3��g����H=-196kJ/mol����ʼͶ�����������ƽ��ʱ���й��������£�| ʵ�� | �� | �� | �� |
| ��ʼͶ�� | 2molSO21molO2 | 2molSO3 | 4molSO22molO2 |
| ƽ��ʱn��SO3�� | 1.6mol | n2 | n3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ��ϵ��ѹǿ | P1 | P2 | P3 |
| ��Ӧ���ת���� | ��1 | ��2 | ��3 |
| c |
| 2 |
| c |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10�֣���ij�¶��¡��ݻ���Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��
2SO2��g����O2��g��![]() 2SO3��g�� ��H����196kJ��mol��
2SO3��g�� ��H����196kJ��mol��
��ʼͶ����������ﵽƽ��ʱ���й��������£�
��1������ʼͶ��a molSO2��b molO2��c molSO3������ͬ�����£�Ҫ�ﵽ�����ͬ�Ļ�ѧƽ�⣬��a��c��Ӧ����Ĵ�����ϵʽΪ_________;b��c��Ӧ����Ĵ�����ϵʽΪ _________��
��2�����¶��´˷�Ӧ��ƽ�ⳣ��ֵΪ______________��������ͬ�¶���������ʼͶ�� 0��1molSO2��0��1molO2��0��3molSO3����Ӧ��ʼʱ���淴Ӧ���ʵĴ�С��ϵ��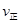 _______
_______![]()
��3�����������еķ�Ӧ�ֱ��ƽ��ʱ�������ݹ�ϵ��ȷ����_______________
A����1����2��1 B��Q1��Q2��196
C����3<��1 D��P3��2P1��2P2
E��n2<n3<3��2mol F��Q3��2Q1
��4����ͼ��ʾ��Ӧ��t1ʱ�̴ﵽ��ѧƽ�⣬��t2ʱ��ı�ij�������������仯������� ��t2ʱ�̸ı������������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ�����и���������ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
������Ԫ��A��B��C��D��Eԭ��������������A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�Bԭ�ӵļ۵��������ڸ�Ԫ����ͻ��ϼ۵ľ���ֵ��C��D���γ�D2C��D2C2���ֻ������D��ͬ�����н�������ǿ��Ԫ�أ�E�ĸ�һ��������C��A�γɵ�ij�ֻ�������Ӻ�����ͬ�ĵ�������
��1��A��C��D�γɵĻ������к��еĻ�ѧ������Ϊ ��
��2����֪����E��E��2E������H����a kJ��mol-1
�� 2A����A��A����H=��b kJ��mol-1
��E����A����A��E����H=��c kJ��mol-1����������ʾ�γɹ��ۼ����ṩ�ĵ��ӣ�
д��298Kʱ��A2��E2��Ӧ���Ȼ�ѧ����ʽ ��
��3����ij�¶��¡��ݻ���Ϊ2L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��2A2��g����BC��g��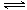 X��g������H����dJ��mol��1��d��0��XΪA��B��C����Ԫ����ɵ�һ�ֻ��������ʼͶ����������ﵽƽ��ʱ���й��������£�
X��g������H����dJ��mol��1��d��0��XΪA��B��C����Ԫ����ɵ�һ�ֻ��������ʼͶ����������ﵽƽ��ʱ���й��������£�
|
ʵ�� |
�� |
�� |
�� |
|
��ʼͶ�� |
2 molA2��1 molBC |
1 molX |
4 molA2��2 molBC |
|
ƽ��ʱn��X�� |
0.5mol |
n2 |
n3 |
|
��Ӧ�������仯 |
�ų�Q1kJ |
����Q2kJ |
�ų�Q3kJ |
|
��ϵ��ѹǿ |
P1 |
P2 |
P3 |
|
��Ӧ���ת���� |
��1 |
��2 |
��3 |
���ڸ��¶��£�����������ӷ�Ӧ��ʼ��ƽ������ʱ��Ϊ4 min�����ʱ�����A2��ƽ����Ӧ����v(A2) ��
�ڸ��¶��´˷�Ӧ��ƽ�ⳣ��K��ֵΪ ��
�����������еķ�Ӧ�ֱ��ƽ��ʱ�������ݹ�ϵ��ȷ���� ������ţ���
A����1����2��1 B��Q1��Q2��d C����3����1
D��P3��2P1��2P2 E��n2��n3��1.0mol F��Q3��2Q1
���������������������£�������������ϵ���ѹ����1L�����ڵ�8min�ﵽ�µ�ƽ��ʱA2����ת����Ϊ65.5%��������ͼ�л�����5min ����ƽ��ʱX�����ʵ���Ũ�ȵı仯���ߡ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com