
【题目】净水剂能够改善水质,给人们的生活、健康带来很大的益处。
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为_______;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有____的作用。
(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为_____________、_______;溶解过程中需不断搅拌,目的是________________。
②加适量铝粉的主要作用是_______________。
③蒸发浓缩所需玻璃仪器为_______________。
【答案】 KAl(SO4)2=K++A13++2SO42- 凝聚水中的悬浮物,并能吸附色素 Al2O3+6H+=2A13++3H2O Fe2O3+6H+=2Fe3++3H2O 加快反应速率 除去浊液中的H+和Fe3+ 酒精灯、玻璃棒
【解析】(1)KAl(SO4)2·12H2O]在水中的电离方程式为KAl(SO4)2=K++A13++2SO42-;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有凝聚水中的悬浮物,并能吸附色素的作用。(2)①盐酸溶解铝土矿过程中,氧化铝、氧化铁与盐酸均反应,反应的离子方程式为Al2O3+6H+=2A13++3H2O、Fe2O3+6H+=2Fe3++3H2O;溶解过程中需不断搅拌,目的是增大反应物的接触面积,加快反应速率。②要得到氯化铝溶液,就需要除去溶液中的铁离子以及氢离子,因此加适量铝粉的主要作用是除去浊液中的H+和Fe3+。③蒸发浓缩所需玻璃仪器为酒精灯、玻璃棒。


科目:高中化学 来源: 题型:
【题目】A、B、C、D.E是短周期元素,周期表中A与B、C与E相邻;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红。
(1)E的元素名称是_______,该己素在周期表中的位置为_______。
(2)A、B、C的氢化物稳定性又弱到强的顺序为(用分子式表示)_______;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为________。
(3)写出D2C2的电子式________。用电子式表示只含D、E两种元素的化合物的形成过程________。
(4)写出D2C2与H2O反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法,正确的是( )
A.透明陶瓷材料硒化锌是由主族元素和副族元素形成的化合物
B.元素的性质随着相对原子质量的增加而呈周期性的变化
C.俄国化学家凯库勒为元素周期表的建立做出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是( )
A.26Fe的价层电子排布式为3d64s2
B.35Br的电子排布式可简写为[Ar]4s24p5
C.NH4Cl的电子式为 
D.某基态原子核外电子排布图为: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法不正确的是( )
A.氧化反应和还原反应同时发生
B.一定存在着电子转移
C.一定存在着元素化合价变化
D.一定有单质参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在人类生产生活中有着广泛的应用,下列说法不正确的是( )
A.利用焰色反应可制成节日烟花
B.硅胶用作食品干燥剂
C.医用酒精的浓度为95%,此浓度杀灭新冠病毒效果最好
D.铁盐和铝盐可用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 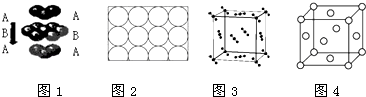
A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围距离相等且为 ![]() acm的CO2有8个
acm的CO2有8个
D.图4这种金属晶体的晶胞,是金属原子在三维空间里以密置层采取ABCABC…堆积的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
I.含有极性键和非极性键的是___________________;含有非极性键的离子化合物是____________。(均填序号)
II.下表为元素周期表的一部分,请参照元素①一⑨在表中的位置,用化学用语回答下列问题:
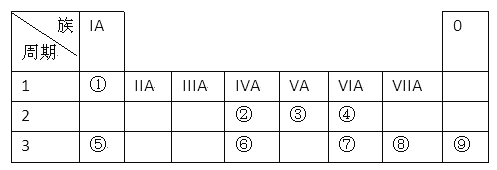
(1)在①~⑨元素中,金属性最强的元素是_____________,化学性质最稳定的元素是________________。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是____________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
请设计一个实验,证明元素②与元素⑥的非金属性强弱,只写出反应的化学方程式(不写实验步骤)_____________________________________________________。
(3)⑧构成的单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(该反应为放热反应),生成物中三种含Y 元素的离子,其中两种离子物质的量(n) 与反应时间(t) 的变化如图所示,写出该反应的离子方程式是_______________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丙炔酸(![]() )广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是
)广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是
A. 分子式为C9H7O2
B. 与丙炔酸(![]() )互为同系物
)互为同系物
C. 是高分子化合物![]() 的单体
的单体
D. 1mol苯丙炔酸最多可与5mol氢气发生反应,可以发生缩聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com