
| A. | A与B的相对分子质量之比为m:n | |
| B. | 同温同压下,两气体A与B的密度之比为n:m | |
| C. | 同质量的A与B分子个数之比为m:n | |
| D. | 相同状况下,同体积的气体A与B 质量比为m:n |
分析 A.气体的分子数相同,则A与B的物质的量相同,相对分子质量之比等于摩尔质量之比;
B.同温同压下,两气体的密度之比摩尔质量之比;
C.同质量的A与B分子个数之比等于摩尔质量的反比;
D.相同状况下,同体积的气体A与B,二者物质的量相同,质量之比等于摩尔质量之比.
解答 解:A.标准状况下mg气体A和ngB气体的分子数相同,则A与B的物质的量相同,相对分子质量之比等于摩尔质量之比等于二者质量之比为m:n,故A正确;
B.由A知,A与B摩尔质量之比为m:n,同温同压下,两气体的密度之比摩尔质量之比为m:n,故B错误;
C.由A知,A与B摩尔质量之比为m:n,同质量的A与B分子个数之比等于摩尔质量的反比为n:m,故C错误;
D.由A知,A与B摩尔质量之比为m:n,相同状况下,同体积的气体A与B,二者物质的量相同,所以二者质量之比等于摩尔质量之比为m:n,故D正确.
故选BC.
点评 本题考查了阿伏伽德罗定律及推论、常用化学计量的有关计算,难度不大,可借助PV=nRT理解阿伏伽德罗定律及推论.


科目:高中化学 来源: 题型:实验题
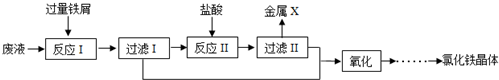
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
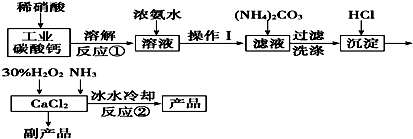
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 硅是人类将太阳能转换为电能的常用材料 | |
| D. | 由粗硅制备单晶硅不涉及氧化还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com