
| A、铁溶于稀硝酸溶液变为浅绿色:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
| C、向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2═2I2+2H2O |
| D、向水杨酸 |
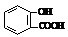 )反应,可静脉注滴NaHCO3溶液的离子反应为
)反应,可静脉注滴NaHCO3溶液的离子反应为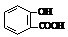 +HCO3-→
+HCO3-→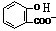 +CO2↑+H2O,故D错误.
+CO2↑+H2O,故D错误.

科目:高中化学 来源: 题型:
 在不同温度下,反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:
在不同温度下,反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:| 温度/℃ | 700 | 800 | 850 | 1000 | 1200 |
| 平衡常数K | 2.6 | 1.7 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
(1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:| 电解质 | HF | CH3COOH | HNO2 | NH3?H2O |
| 电离平衡常数K | 3.53×10-4 | 1.76×10-5 | 4.6×10-4 | 1.77×10-5 |
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/K | 反应① | 反应② | 反应③ |
| 298 | 2.96×109 | 2.53×109 | 1.32×1015 |
| 423 | 1.05×102 | 5.40×102 | 2.52×102 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2与足量Fe反应转移电子数为3NA |
| B、在1L 1mol?L-1的AlCl3溶液中,Cl-离子的数目小于3NA |
| C、1mol Na2O和Na2O2的混合晶体中含有的阴、阳离子总数是3NA |
| D、在某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应后,可得0.2NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1所示装置除去Cl2中含有的少量HCl |
| B、用图2所示装置蒸发KCl溶液制备无水KCl |
| C、用图3所示装置可以完成“喷泉”实验 |
| D、用图4所示装置制取、收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 转化率(%) | 物质的量(mol) | ||
| H2 | CO2 | CH3OH | CO | |
| 240℃ | 10 | 0.05 | 0.05 | |
| A、升高温度,反应①的平衡常数减小 |
| B、升高温度,CH3OH的含量提高 |
| C、H2转化率为10% |
| D、100min内,反应②的速率为v(CO2)=0.0001mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该装置将化学能转变为电能 |
| B、溶液中的阳离子向锌电极移动 |
| C、Cu极上有气泡产生,发生还原反应 |
| D、电流方向是从铜片流向锌片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com