
| A、C02、CS2、SO2都是直线型的分子 |
| B、COCl2、SF6、CO32-都是平面三角型的分子 |
| C、BF3分子的键角大于CH4分子的键角 |
| D、PCl3、NH3、BCl3都是三角锥形的分子 |
| 6-1×2 |
| 2 |
| 3-1×3 |
| 2 |
| 4-1×4 |
| 2 |
| 5-1×3 |
| 2 |
| 3-1×3 |
| 2 |


科目:高中化学 来源: 题型:
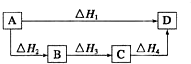
| A、△H1=△H2=△H3=△H4 |
| B、△H1-△H2-△H3=△H4 |
| C、△H1-△H3=△H2-△H4 |
| D、△H1>△H2>△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| (1) | 酒精(水) | ||
| (2) | 乙烷(乙烯) | ||
| (3) | 硬脂酸钠溶液(甘油) | ||
| (4) | 苯(苯酚) | ||
| (5) | SiO2(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN | C6H5ON | Na2CO3 |
| pH | 8.8 | 9.0 | 10.3 | 11.1 | 11.3 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5 mol/L |
| B、1.5 mol/(L?s) |
| C、0.1 mol/L |
| D、0.1 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加碘食盐能使淀粉溶液变蓝 |
| B、用溴水验证汽油中含有不饱和烃 |
| C、常用危险化学品酒精和甲烷的标志都是易燃液体 |
| D、油脂在酸性条件下的水解反应也称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素名称 | 氟 | 氯 | 溴 | 碘 | 砹 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 离子各一个)
离子各一个)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成 |
| B、在常温下,Na2CO3+2HCl═2NaCl+CO2↑+H2O,说明HCl酸性强于H2CO3;在高温下,Na2CO3+SiO2═Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3 |
| C、H2SO4为强酸,推出HClO4为强酸 |
| D、NH3的沸点高于PH3,推出CH4沸点高于SiH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com