
【题目】(加试题)三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,常用于制作重要的电子元件材料和蓄电池材料。某实验室尝试用工业废弃的NiO催化剂(还含有Fe2O3、CaO、CuO、BaO等杂质)为原料生产2NiOOHH2O沉淀,继而制备Ni2O3。实验工艺流程为:
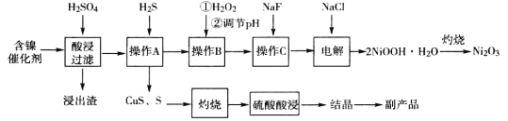
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.6 | 9.7 | 9.2 |
②常温下CaF2难溶于水,微溶于无机酸
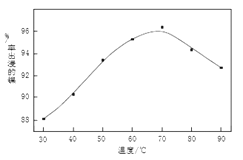
(1)操作B中需调节pH范围为____,使用Na2CO3调节pH过程中发生的反应有___。实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图所示。请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因____。
(2)下列说法正确的是____
A.为提高酸浸效率,可充分搅拌或适当提高硫酸浓度
B.操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀
C.浸出渣的主要成分为CaSO42H2O和BaSO4
D.为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
(3)电解过程中,Cl-在阳极被氧化为ClO-,但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式_____。
(4)操作C加入NaF后如何证明沉淀完全____。
(5)工业上也可通过将草酸镍(NiC2O42H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为____。
【答案】3.6~7.2 CO32-+2H+═CO2↑+2H2O,2Fe3+ +3CO32- +3H2O=2Fe(OH)3↓+3CO2↑ 温度升高,Ni2+的水解程度增大,浸出渣中Ni(OH)2含量增大,浸出率降低 AC ClO-+2Ni2++4OH-=2NiOOH·H2O↓+Cl- 静置取上层清液少许于试管中,再加入适量NaF溶液,若试管内无沉淀产生说明已经沉淀完全 2NiC2O4![]() Ni2O3+3CO↑+CO2↑
Ni2O3+3CO↑+CO2↑
【解析】
含镍催化剂与硫酸反应后Ba2+形成BaSO4沉淀,通入硫化氢气体将Cu2+沉淀,操作B除去Fe3+,操作C除去Ca2+,最后加氯化钠电解硫酸镍溶液得到2NiOOH![]() H2O↓,最终得到Ni2O3,据此分析作答。
H2O↓,最终得到Ni2O3,据此分析作答。
(1)亚铁离子不易除去,为了使铁元素被过氧化氢氧化到Fe3+并彻底除去,需调节pH至高于沉淀前的pH且低于Ni(OH)2开始沉淀的pH,防止Ni元素的损失,即pH范围为3.6~7.2;加入碳酸钠调节过程中CO32-先与酸浸时过量H+反应,再与Fe3+发生双水解生成Fe(OH)3沉淀,则离子方程式为:CO32-+2H+═CO2↑+2H2O,2Fe3+ +3CO32- +3H2O=2Fe(OH)3↓+3CO2↑;随着温度升高,镍离子的水解程度增大,浸出渣中氢氧化镍的含量增大,浸出率降低。故答案为:3.6~7.2;CO32-+2H+═CO2↑+2H2O,2Fe3+ +3CO32- +3H2O=2Fe(OH)3↓+3CO2↑;温度升高,Ni2+的水解程度增大,浸出渣中Ni(OH)2含量增大,浸出率降低;
(2)A. 充分搅拌,适当提高酸浓度的方法可以促进金属氧化物的反应,A项正确;
B.持续通入过量H2S,虽有助于Cu2+沉淀完全,但是额外消耗后续操作中添加的H2O2,造成试剂浪费,因此应通适量H2S即可,B项错误;
C. 硫酸与氧化镍、氧化铁、氧化钙、氧化铜、氧化钡分别生成硫酸盐产物,其中硫酸钡和硫酸钙难溶,因此浸出渣的主要成分为CaSO4![]() 2H2O和BaSO4,C项正确;
2H2O和BaSO4,C项正确;
D. 副产品胆矾含有结晶水,不可用蒸发结品方法分离提纯,D项错误,
故答案为:AC;
(3)Ni2+被ClO-氧化产生2NiOOH![]() H2O↓,ClO-被还原为Cl-,根据得失电子相等和电荷守恒、质量守恒配平得到ClO-+2Ni2++4OH-=2NiOOH·H2O↓+Cl-。
H2O↓,ClO-被还原为Cl-,根据得失电子相等和电荷守恒、质量守恒配平得到ClO-+2Ni2++4OH-=2NiOOH·H2O↓+Cl-。
(4)证明所有Ca2+均发生沉淀,可以静置取上层清液少许于试管中,再加入适量NaF溶液,若试管内无沉淀产生说明已经沉淀完全;
(5)草酸镍在热空气中干燥脱水后生成NiC2O4,再发生氧化还原反应,Ni由+2价升高到 +3价,则C由+3价降低到+2价,因生成混合气体,则另一气体为CO2,即生成Ni2O3、CO和CO2,再利用化合价升降相等,配平方程式为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑。
Ni2O3+3CO↑+CO2↑。


科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是
A.64g二氧化硫中的氧原子数和标准状况下22.4L二氧化碳中的氧原子数
B.200mL1mol/L氯化钙溶液中c(Cl-)和100mL1mol/L氯化钾溶液中c(Cl-)
C.2mol水的摩尔质量和1mol水的摩尔质量
D.20%氢氧化钠溶液中氢氧化钠物质的量浓度和10%氢氧化钠溶液中氢氧化钠物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是__________。
A 溶液中导电粒子的数目减少 B 醋酸的电离程度增大,c(H+)亦增大
C 溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]不变 D 溶液中c(CH3COO-)/c(H+)减小
(2)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=_____________(溶液体积变化忽略不计)。
(3)常温下,浓度均为0.lmol/L的下列五种溶液的pH值如表所示:
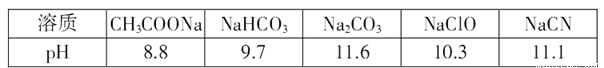
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_____
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A CH3COOH+Na2CO3=NaHCO3+CH3COONa B CH3COOH+NaCN=HCN+CH3COONa
C CO2 +H2O+ 2NaClO=Na2CO3+2HClO D NaHCO3+HCN=NaCN+CO2 +H2O
(4)几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度离子Cu2+、Fe2+、Mg2+的溶液中滴加NaOH溶液时,_________(填离子符号)先沉淀。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__________;
②体积相同、c(H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是
等。下列说法正确的是
A. ![]() 和
和![]() 的化学性质完全不同
的化学性质完全不同
B. 元素Ts的相对原子质量为![]()
C. 基态![]() 原子核外电子共占据7个能级
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe + CuSO4 = FeSO4+ Cu
B. AgNO3+ NaCl= AgCl↓ + NaNO3
C. MnO2 + 4 HCl(浓) ![]() MnCl2+ Cl2↑ + 2 H2O
MnCl2+ Cl2↑ + 2 H2O
D. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________,P、S、Cl的第一电离能由大到小顺序为____________________,P、S、Cl的电负性由大到小顺序为_______________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_______________________________。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______。
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
A.把制得的溶液小心地转移至容量瓶中。B.在天平上称出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。C.继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切。D.用少量蒸馏水洗烧杯和玻璃棒2—3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。E.将容量瓶塞塞紧,充分摇匀。请填写下列空白:
(1)容量瓶上需标有以下五项中的___。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(2)操作步骤的正确顺序为(填序号)___。
(3)本实验用到的基本仪器已有烧杯、量筒、天平(砝码、镊子)、玻璃棒,还缺少的仪器是___、___、___。
(4)下列情况会使所配溶液浓度偏高的是(填序号)___。
a.某同学观察液面的情况如图所示

b.没有进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶用前内壁沾有水珠
(5)操作D的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况时,8.96L的容器里所含CO的质量为11.2g,则一氧化碳的摩尔质量为____________ g/mol ;
(2)3.01×1023个OH-的物质的量是 __________ mol,质量为_____g,其质子数为________(用NA表示),电子数为 ___________(用NA表示);
(3)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,氧杂螺戊烷的结构简式为![]() ,则下列说法正确的是
,则下列说法正确的是
A. lmol该有机物完全燃烧需要消耗5.5molO2
B. 二氯代物超过3种
C. 该有机物与环氧乙烷互为同系物
D. 该有机物所有碳、氧原子处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com