
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
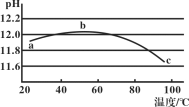
A.b点水解程度最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.水解是吸热过程
【答案】A
【解析】
溶液中存在碳酸根的水解平衡![]() 和水的电离平衡
和水的电离平衡![]() ;图中显示温度升高溶液的碱性先增强后减弱,水的电离是吸热过程,纯水中温度升高pH值会降低,碳酸钠溶液中温度升高pH有增大的过程,说明水解受到促进,即水解为吸热过程;后pH值下降,说明温度升高水电离出更多的氢氧根抑制了碳酸根的水解,据此分析作答。
;图中显示温度升高溶液的碱性先增强后减弱,水的电离是吸热过程,纯水中温度升高pH值会降低,碳酸钠溶液中温度升高pH有增大的过程,说明水解受到促进,即水解为吸热过程;后pH值下降,说明温度升高水电离出更多的氢氧根抑制了碳酸根的水解,据此分析作答。
A.根据分析可知水解是吸热过程,温度越高,水解程度越大,故A错误;
B.随温度升高,此时促进盐类水解,对水的电离也起到促进作用,水电离出的氢氧根离子浓度抑制水解平衡,导致溶液pH值减小,因此水的电离平衡也对pH产生影响,故B正确;
C. a→b段说明升温促进水解,氢氧根离子浓度增大,碱性增大溶液pH增大,图象符合,故C正确;
D.根据分析可知水解是吸热过程,故D正确;
故答案为A。


科目:高中化学 来源: 题型:
【题目】面对世界范围内的能源危机,甲醇作为一种可再生能源,有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:____
(2)对于CO(g)+2H2(g)CH3OH(g) ΔH1=-90 kJ·mol-1,在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。

①p1 _______(填“大于”“小于”或“等于”) p2。
②在其他条件不变的情况下,缩小体积使压强增大,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”),平衡常数________(填“增大”“减小”或“不变”)。
(3)已知在温度T时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,判断此时刻υ正________(填“>” 、“=”或“<”)υ逆。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质的化学用语正确的是( )
A.![]() C表示的是核内有13个中子,核外有8个电子
C表示的是核内有13个中子,核外有8个电子
B.H3O+与OH-具有相同的质子数和电子数
C.NaOH的电子式:![]()
D.HClO的结构式:H—Cl—O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
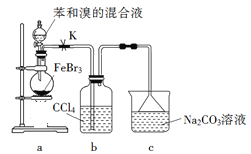
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验![]() 溶液的浓度均为
溶液的浓度均为![]() 。
。
编号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 产生无色气泡 | 产生无色气泡液面上方呈浅红棕色 | 产生无色气泡 |
下列对实验现象的解释或推测不合理的是
A.![]() 中:
中:![]()
B.根据上述实验判断,![]() 的氧化性强于水
的氧化性强于水
C.![]() 中:
中:![]()
D.![]() 中使湿润pH试纸变蓝的气体是
中使湿润pH试纸变蓝的气体是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)写出一种可以提高NO的转化率的方法:__________
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=_____,y=_______。
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:

①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=_______;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。

(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式____。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如下图所示。请回答下列问题:
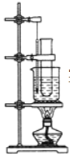
(1)反应需在55~60 ℃的温度下进行,图中给反应物加热的方法是________,
(2)在配制混合酸时先加_____________后加_____________;
(3)该反应的化学方程式是_____________________; 反应类型为:_______;
(4)反应完毕后,除去混合酸,所得粗产品用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④用10% NaOH溶液洗 ⑤水洗 正确的操作顺序是________。
A.①②③④⑤ B.②④⑤③①
C.④②③①⑤ D.②④①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值( )
为阿伏加德罗常数的值( )
A.标准状况下,将![]() 通入水中发生反应,转移的电子数为
通入水中发生反应,转移的电子数为![]()
B.常温常压下, 7g乙烯和丁烯的混合物含有的极性键数目为![]()
C.将![]() 与过量
与过量![]() 反应转移的电子数为
反应转移的电子数为![]()
D.标准状况下,![]() 中所含电子数为
中所含电子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com