
【题目】美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
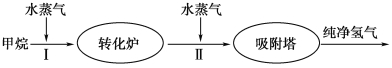
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)此流程的第Ⅱ步反应CO(g)+H2O(g) ![]() H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2正)=v(H2O逆)
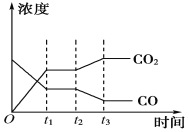
(4)下图表示此流程的第Ⅱ步反应在t1时刻达到平衡,在t2时刻分别因改变某个条件而发生变化的情况:图中t2时刻发生改变的条件可能是________________________(写出两种)。
【答案】c(H2).c(CO2)/[c(CO)c(H2)] 放 50% B ①④⑤⑥ 降低温度或增加水蒸气的量或减少氢气的量
【解析】
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,由表格中的数据可知,温度越大,K越小,则正反应为放热反应,利用830℃下K计算CO的转化率;
(2)利用Q与K的关系可知,Q<K时反应向正反应反应移动;
(3)利用平衡的特征“定”、“等”及由此衍生的物理量来分析;
(4)t2时二氧化碳的浓度增大,而CO的浓度减小,该反应正向移动,以此分析。
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=c(H2).c(CO2)/[c(CO).c(H2)],由表格中的数据可知,温度越高,K越小,则正反应为放热反应,830℃时,
CO(g)+H2O(g)![]() H2(g)+CO2(g),
H2(g)+CO2(g),
开始(mol) 1 1 0 0
转化(mol) x x x x
平衡(mol) 1-x 1-x x x
K=x×x/(1-x)×(1-x)=1,解得x=0.5,则CO的转化率为0.5/1×100%=50%,
故答案为:c(H2)c(CO2)/[c(CO)c(H2)];放;50%。
(2)A.Q=2×3/1×5=1.2>K=1,则向逆反应方向移动,故A不选;
B.Q=1×1/2×2=0.25<K=1,则反应向正反应反应移动,故B选;
C.Q=1×1/0.5×2==K,平衡不移动,故C不选;
故答案为:B。
(3)①该反应在不传热的容器中进行,反应过程中容器内的温度会发生变化,温度变化必然引起压强的变化,则体系的压强不再发生变化时,说明反应达到平衡,故①选;
②固定容积,质量、体积始终不变,则混合气体的密度不变,不能判断平衡,故②不选;
③混合气体的总质量、总物质的量始终不变,则混合气体的平均相对分子质量不变,不能判断平衡,故③不选;
④各组分的物质的量浓度不再改变,为平衡的特征,能判断平衡,故④选;
⑤体系的温度不再发生变化,说明正反应速率等于逆反应速率,反应达到平衡,故⑤选;
⑥v正(CO2)=v逆(H2O),则水的正、逆反应速率相等,达到平衡,故⑥选。
故答案为:①④⑤⑥。
(4)t2时二氧化碳的浓度增大,而CO的浓度减小,该反应正向移动,则改变的条件为降低温度或增加水蒸汽的量或减少氢气的量,
故答案为:降低温度或增加水蒸汽的量或减少氢气的量。


科目:高中化学 来源: 题型:
【题目】![]() 燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
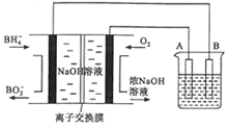
A. 每消耗2.24![]() (标准状况)时,A电极的质量减轻12.8g
(标准状况)时,A电极的质量减轻12.8g
B. 离子交换膜应为阳离子交换膜,![]() 由左极室向右极室迁移
由左极室向右极室迁移
C. 该燃料电池的负极反应式为![]()
D. 粗铜中的Ag、Au沉在阳极区,电解质溶液的浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1025kJmol﹣1
②N2(g)+O2(g)2NO(g)△H=+180.5kJmol﹣1水的汽化热△H=+44kJmol﹣1据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式____________________________________________________________;
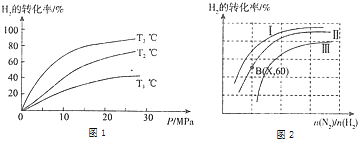
(2)工业时合成氨的原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 。图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为___ , 曲线与曲线对应的压强P1___P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=______________________。
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=___(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
下列各项中能说明反应已达到平衡状态的是_____________________ 。
a.混合气体的平均相对分子质量不变
b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变
d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 , 其总反应是8NO+7H2═3NH4NO3+2HNO3 , 试写出以惰性材料作电极的阴极反应式:___ . 电解过程中为使电解产物全部转化为NH4NO3 , 需要补充NH3的原因是___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。 请回答下列问题:
(1)根据上述实验判断原溶液中肯定存在的离子是______________,肯定不存在的离子是__________。
(2)写出实验②的离子方程式:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是______热反应, Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是________________.反应过程______ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号)。

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中____(填A或B)处电极入口通甲烷,其电极反应式为_____________________ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为_________mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为_______________。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液(混合液)的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | C | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,仅从甲组情况分析,如何用a (混合液的pH)来说明HA是强酸还是弱酸__________。
(2) 不考虑其它组的实验结果,仅从乙组情况分析,C是否一定等于0.2__________(填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是__________。
(3)丙组实验结果分析,HA是__________酸(填“强”或“弱”)。该组混合液中离子浓度由大到小的顺序是__________。
(4)丁组实验混合液中由水电离出的c(OH-)=__________molL﹣1,写出该混合液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)=__________molL-1, c(OH-)-c(HA)=__________molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
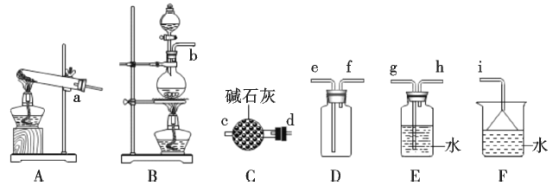
(1)氨气的制备
①氨气的发生装置中反应的化学方程式为__。装置C的仪器名称__。
②欲收集一瓶干燥的氨气,选择上图中的装置,其接口连接顺序为a→__(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
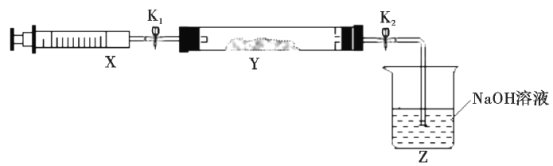
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中__ | ②反应的化学方程式___ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③__ | ④___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验现象的预测正确的是( )
A.  振荡后静置,溶液不再分层,且保持无色透明
振荡后静置,溶液不再分层,且保持无色透明
B.  铁片最终完全溶解,且高锰酸钾溶液变无色
铁片最终完全溶解,且高锰酸钾溶液变无色
C.  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终无明显变化
微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终无明显变化
D.  当液体变成红褐色时,停止加热,让光束通过分散系时可产生丁达尔效应
当液体变成红褐色时,停止加热,让光束通过分散系时可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生设计的用氨催化氧化法制取少量HNO3溶液的实验装置如图所示:
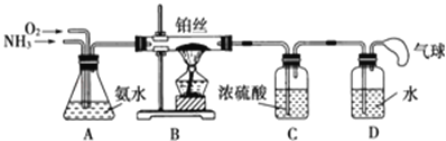
(1)实验室制备NH3,下列方法中适宜选用的是__(填序号)。
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③碱石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为__;
(3)装置C的作用是__;装置C中的现象___;为确保装置D中尽可能多地生成HNO3,所通入O2和NH3的体积比应大于___;
(4)装置D中发生的反应化学方程式为___。(请分步写出化学方程式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com