
【题目】通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJmol﹣1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJmol﹣1
则下列说法正确的是( )
A.升高a的反应温度,乙醇的转化率增大
B.由b可知:乙醇的燃烧热为13.8 kJmol﹣1
C.2H2(g)+O2(g)=2H2O(g)△H=+485.6 kJmol﹣1
D.制取等量的氢气,途径b消耗的能量更多
科目:高中化学 来源: 题型:
【题目】下列关于仪器使用的说法正确的是( )
A.滴定管装滴定液时应先用蒸馏水洗净
B.锥形瓶用作反应容器时一定不能加热
C.蒸馏时温度计水银球可以高于蒸馏烧瓶支管口
D.振荡分液漏斗时应关闭玻璃塞和活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为mol/L.
(2)NOx是汽车尾气中的主要污染物之一. ①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是 .
②NOx能形成酸雨,由NO2形成酸雨的主要反应是(写离子方程式).
(3)为减少SO2的排放,常采取的措施有: ①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是 .
②吸收烟气中的SO2 , 以下物质可作吸收剂的是(填序号);硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式 . a.NaOH b.H2SO4 c.NaHSO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的Fe (NO3)2溶液中逐滴加入少量的稀硫酸时,溶液的颜色变化应该是
A. 颜色变浅 B. 变为血红色 C. 没有改变 D. 变为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:Cu2S+2Cu2O ![]() 6Cu+SO2↑,下列说法错误的是( )
6Cu+SO2↑,下列说法错误的是( )
A.在Cu2O、Cu2S中Cu元素化合价都是+1价
B.反应中Cu元素被氧化,S元素被还原
C.Cu2S在反应中既是氧化剂,又是还原剂
D.每生成6.4g Cu,反应中转移0.1 mole﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( ) 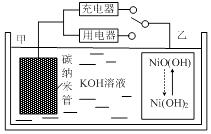
A.放电时,甲电极为正极,OH﹣移向乙电极
B.放电时,乙电极反应为:NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH ![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是( ) 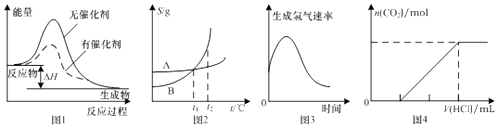
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 molL﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下: 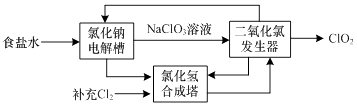
①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中化学的叙述中,正确的是
A.只用米汤就能检验出食盐中是否加碘
B.可用热的纯碱溶液清洗油污
C.“光化学烟雾”的形成与二氧化硫有关
D.用硅单质制光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com