
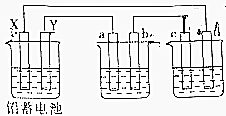
 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )| A. | 电路中通过1mol电子时,Y电极质量增加48g | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO${\;}_{4}^{2-}$(aq)+2e-=PbSO4(s)+2H2O(l) | |
| C. | c、d电极产生气体的物质的量之比为1:2 | |
| D. | X极为负极 |
分析 通电时a电极质量增加,说明银离子放电生成单质银,所以a为阴极,Y为负极,X为正极,左边是原电池,右边两个池是电解池,由此分析解答.
解答 解:A、Y电极是负极,铅放电生成硫酸铅,电路中通过1mol电子时,增加0.5molSO42-,质量增加0.5×96=48g,故A正确;
B、放电时铅蓄电池负极发生氧化反应,而不是还原反应,故B错误;
C、c是阴极产生氢气、d电极是阳极产生氧气,c、d电极产生气体的物质的量之比为2:1,故C错误;
D、X为正极,而不是负极,故D错误;
故选A.
点评 本题考查了电解原理,难度不大,能准确判断电解池的阴阳极是解本题的关键,而通电时a电极质量增加是解题的突破口.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 植物体中的叶绿素把CO2 和水转化为葡萄糖 | |
| B. | 次氯酸的分解 | |
| C. | 铁与氧气的反应 | |
| D. | 甲烷与氯气的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠、二氧化硫属于氧化物,而次氯酸属于弱酸,臭氧属于单质 | |
| B. | 它们都能使品红溶液褪色,但褪色原理不同;加热褪色的溶液都能变红 | |
| C. | 二氧化硫能与其他三种物质发生氧化还原反应,二氧化硫表现还原性 | |
| D. | 过氧化钠溶于水产生的气体与臭氧互为同素异形体,臭氧比氧气活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-4 mol•L-1的溶液中:NH4+、K+,SO42-,NO3- | |
| B. | 无色溶液中:Na+,Cu2+,Cl-,NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液中:H+,K+,SO42-,I- | |
| D. | 饱和氯水中:Cl-,Na+,NO3-,SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: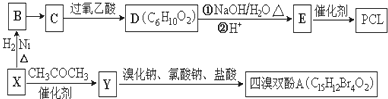
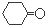

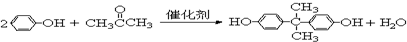 .
.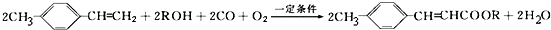
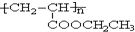 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: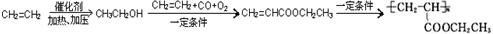 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com