
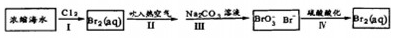
分析 (1)金为不活泼金属自然界中主要是游离态;
(2)浓缩海水中通入氯气得到溴单质,吹入热的空气吹出溴单质被碳酸钠溶液吸收辐射反应生成溴离子、溴酸根离子,再加入硫酸酸化发生溴元素的归中反应生成溴单质,
①步骤Ⅰ发生的反应为氯气氧化溴离子生成溴单质;
②溴单质被碳酸钠溶液吸收发生歧化反应,生成溴华纳、溴酸钠和水;
③步骤Ⅳ中发生的反应是溴化钠和溴酸钠在酸溶液中发生归中反应得到溴单质,结合反应定量关系计算电子转移;
(3)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁;
①Mg(s)+2HCl(aq)═MgCl2(aq)+H2(g)△H=-akJ/mol
②H2(g)+Cl2(g)═2HCl(aq)△H=-bkJ/mol
③MgCl2(aq)═MgCl2(s)△H=-ckJ/mol
结合盖斯定律计算①+②+③,方向改变后得到.
解答 解:(1)金为不活泼金属自然界中主要是游离态,海水中金元素储量约为5×102t,金元素在自然界的主要存在形态是游离态,
故答案为:游离态;
(2)浓缩海水中通入氯气得到溴单质,吹入热的空气吹出溴单质被碳酸钠溶液吸收辐射反应生成溴离子、溴酸根离子,再加入硫酸酸化发生溴元素的归中反应生成溴单质,
①步骤Ⅰ发生的反应为氯气氧化溴离子生成溴单质,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
②溴单质被碳酸钠溶液吸收发生歧化反应,生成溴华纳、溴酸钠和水,反应的离子方程式为:3Br2+3Na2CO3═NaBrO3+3CO2↑+3NaBr,
故答案为:3、3、1、3、3NaBr;
③步骤Ⅳ中发生的反应是溴化钠和溴酸钠在酸溶液中发生归中反应得到溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,
生成3molBr2转移电子为5mol电子,
结合反应定量关系计算电子转移,生成1molBr2转移$\frac{5}{3}$mol电子,
故答案为:$\frac{5}{3}$;
(3)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,该反应的化学方程式:MgCl2•6H2O$\frac{\underline{\;高温\;}}{\;}$MgO+2HCl↑+5H2O↑,
①Mg(s)+2HCl(aq)═MgCl2(aq)+H2(g)△H=-akJ/mol
②H2(g)+Cl2(g)═2HCl(aq)△H=-bkJ/mol
③MgCl2(aq)═MgCl2(s)△H=-ckJ/mol
结合盖斯定律计算①+②+③,方向改变后得到:MgCl2(s)=Mg(s)+Cl2(g)△H=+(a+b+c)KJ/mol,
故答案为:MgO;MgCl2(s)=Mg(s)+Cl2(g)△H=+(a+b+c)KJ/mol;
点评 本题考查了海水资源的利用和流程分析判断、氧化还原反应电子转移计算、热化学方程式计算、盐类水解等,掌握基础是解题关键,题目难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 燃煤时加入石灰石,可减少硫氧化物的排放 | |
| B. | 氯水中加入适量石灰石,可增强氯水的漂白性 | |
| C. | 酸性土壤中加入适量的熟石灰,可以中和其酸性 | |
| D. | 盐碱地(含较多NaCl、Na2CO3)中施用熟石灰,可降低土壤的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | 某种氧化物是淡黄色固体 |
| X | 短周期中最高价氧化物对应水化物酸性最强 |
| Y | 第三周期中离子半径最小的 |
| Z | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| A. | W、Y、X的原子半径依次减小,Y、W、X简单离子的半径依次增大 | |
| B. | W、X、Y的最高价氧化物的水化物之间可以两两反应 | |
| C. | W的氧化物与Z的最高价氧化物反应一定是氧化还原反应 | |
| D. | 金属性W比Y强,非金属性Z比X弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①中加人试剂顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液 | |
| B. | 过程②为电解熔融精盐 | |
| C. | 工业上过程③加入的试剂为浓NaOH溶液 | |
| D. | 第④步反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
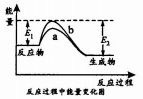
| A. | △H=+|E1-E2| | |
| B. | 曲线a为催化剂时的反应 | |
| C. | X(g)的能量高于Z(g)的能量 | |
| D. | 反应物吸收的总能量大于生成物释放的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 | B. | Na2O+H2O═2NaOH | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
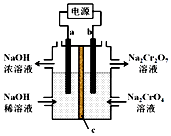 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )| A. | a连接电源负极 | |
| B. | b极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c为阳离子交换膜 | |
| D. | 通过2 mol电子时生成1 mol Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
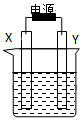 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )| A. | X电极连接电源正极 | B. | 生成气体体积为0.56L | ||
| C. | Y电极上发生氧化反应 | D. | 该CuCl2溶液浓度为0.05mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com