
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] | |
| C. | 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol•L-1 |
分析 A.Ksp是温度的常数;
B、溶度积表达式类型不同,不能说明大小;
C、依据溶度积常数以及水的离子积常数计算即可;
D、依据pH计算氢离子浓度,然后计算氢氧根浓度,再计算判断即可.
解答 解:A、Ksp是温度的常数,只随温度改变而改变,不同物质的溶解能力不同,与物质本身的性质有关,故A正确;
B、将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明硫酸钙的溶解度小,但溶度积表达式类型不同,不能说明大小,故B错误;
C、Ksp[Fe(OH)3]=c3(OH-)•c(Fe3+),反应的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=4.0×104,故C正确;
D.测得混合液的pH=11,Ksp[Mg(OH)2]=c2(OH-)•c(Mg2+),c(OH-)=10-3,带入求得c(Mg2+)=1.8×10-3mol/L,故D正确;
故选:B.
点评 本题考查了沉淀溶解平衡的应用,溶度积计算分析,平衡移动方向的判断,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3 NA | |
| B. | 1 2.5 mL1 6 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2 NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中含有的阴离子数等于0.1 NA | |
| D. | 0.5 mol氧单质含有NA个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
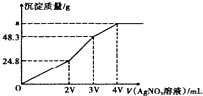 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )| A. | 所加AgNO3溶液的物质的量浓度为$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B. | a的数值为62.65 | |
| C. | 常温下,AgCl,AgI,AgS在水中溶解能力依次减小 | |
| D. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4的沸点高于CH4,可推测PH3的沸点也高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | PCl3 为三角锥形,可推测NF3也为三角锥形结构 | |
| D. | C2H6的碳链是直线型的,可推测C3H8的碳链也是直线型的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少含有4种离子 | |
| B. | 取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀 | |
| C. | 若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+ | |
| D. | 溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ NH+4 Fe2+ Ba2+ Cu2+ |
| 阴离子 | OH- I- NO3- AlO2- HCO3- HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:C>Si | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 还原性:HI>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O与水反应:O2-+H2O═2OH- | |
| B. | SO2使氯水褪色:SO2+Cl2+2H2O═4H++SO42-+2Cl- | |
| C. | Na2SiO3溶液与盐酸反应:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com