
| A. | ②③④⑤⑥ | B. | ①③④⑤ | C. | ①②③④⑤ | D. | ③④⑤ |
分析 ①每个磷原子与其它3个P形成了3个共价键,利用均摊法计算出12.4g白磷中含有的共价键数目;
②根据铜与稀硫酸不发生反应分析生成的二氧化硫的数目.
③根据过氧化钠和氯化钠的摩尔质量都是78g/mol,且过氧化钠中的阴离子为过氧根离子计算含有的阴离子数目;
④二氧化硫与氧气反应生成三氧化硫的反应为可逆反应,反应物只能部分转化成生成物;
⑤根据化学式2CaSO4•H2O中含有一个结晶水进行计算含有的结晶水分子数;
⑥羟基不显电性.
解答 解:①12.4g白磷中含有磷原子的物质的量为0.4mol,每个磷原子与其它3个磷原子形成3个P-P键,每个磷原子形成的共价键数目为:$\frac{1}{2}$×3=$\frac{3}{2}$,所以0.4molP形成的共价键物质的量为:$\frac{3}{2}$×0.4mol=0.6mol,含有的P-P键数是0.6×6.02×1023,故①正确;
②含0.2mol H2SO4的浓硫酸与足量铜反应,消耗0.2mol浓硫酸会生成0.1mol二氧化硫;由于随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以反应生成SO2的物质的量小于0.1mol,分子数小于0.1×6.02×1023,故②错误;
③7.8g Na2S和Na2O2的混合物的物质的量为0.1mol,含有阴离子的物质的量为0.1mol,含有的阴离子数为0.1×6.02×1023,故③错误;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,由于该反应为体积减小的可逆反应,反应生成的三氧化硫的物质的量小于2mol,反应后气体的物质的量大于2mol,分子数大于2×6.02×1023,故④错误;
⑤2.9g 2CaSO4•H2O的物质的量为0.01mol,含有的结晶水的物质的量为0.02mol,分子数为0.01×6.02×1023(2CaSO4•H2O式量为290),故⑤错误;
⑥羟基不显电性,1mol-OH含9mol电子,即3NA个,故⑥错误.故选A.
点评 本题为物质的量基本计算题型,高考常考题型,要注意的是对化学式中隐含的微观信息的挖掘.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做新制氢氧化铜反应实验--检验淀粉是否水解 | |
| B. | 向1-溴丙烷中加入氢氧化钠溶液并加热,再滴加硝酸银和稀硝酸溶液--检验有机物中是否含有溴元素 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 向含苯酚的苯溶液中滴加浓溴水,过滤--除去苯中的苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法正确的是( )| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | 非金属性:X>Z | |
| D. | M元素最高价氧化物对应水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 ml | B. | 500 ml | C. | 1500 ml | D. | 100 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1 nm~100 nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 渗析是鉴别溶液和胶体的最简便的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原硅酸是白色胶状物,失去部分水后变成白色粉末状硅酸 | |
| B. | SiO2分子由一个硅原子和两个氧原子构成 | |
| C. | SiO2溶于水后则慢慢生成硅酸 | |
| D. | SiO2既能与酸反应,又能与强碱反应,故它是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
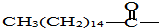 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 无味氯霉素的水溶性变差,所以苦味消失 | |
| B. | 无味氯霉素失去了药性,所以苦味消失 | |
| C. | 无味氯霉素是棕榈酸的盐类 | |
| D. | 无味氯霉素在人体内不会发生水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com