
【题目】下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子 ![]() Cl
Cl
B.氯离子(Cl﹣)的结构示意图: 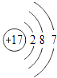
C.氯分子的电子式: ![]()
D.氯乙烯分子的结构简式:H3C﹣CH2Cl
【答案】C
【解析】解:A、元素符号的左上角标质量数,中子数为20的氯原子,质量数=17+20=37,故正确应为:1737Cl,故A错误; B、Cl原子得到1个电子形成最外层满足8个电子的Cl﹣ , 离子结构示意图为: 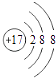 ,故B错误;
,故B错误;
C、氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构,电子式为: ![]() ,故C正确;
,故C正确;
D、氯乙烯分子中存在碳碳双键,正确的结构简式为:H2C=CHCl,故D错误,故选C.
A、元素符号的左上角标质量数,质量数=质子数+中子数;
B、氯离子(Cl﹣)为Cl原子得到1个电子形成的阴离子,最外层满足8个电子的稳定结构;
C、氯气为双原子分子,最外层均满足8个电子的稳定结构;
D、氯乙烯分子中存在碳碳双键,据此解答即可.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6 . 人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mgL﹣1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
(1)测定目的:测定某品牌软包装橙汁中维生素C的含量. 测定原理:C6H8O6+I2→C6H6O6+2H++2I﹣ .
实验用品:①仪器:(自选,略).
试剂:指示剂(填名称)、浓度为7.5×10﹣3 molL﹣1的标准碘溶液、蒸馏水等.
(2)实验过程: ①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②打开橙汁包装,目测:颜色﹣﹣橙黄色,澄清度﹣﹣好.用(填仪器名称)向锥形瓶中量入20.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的(填部位),右手摇动锥形瓶,眼睛注视 , 直到滴定终点,滴定至终点的现象是 .
(3)数据记录与处理:如图1为某一次滴定管滴定前液面,其读数值为mL图2为滴定结束液面,则本次滴定过程共使用了mL标准碘溶液 几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则此橙汁中维生素C的含量是mgL﹣1 .
(4)问题讨论:取标准碘溶液的滴定管洗涤之后直接装液开始滴定,则测定结果 . (填“偏高”、“偏低”、“无影响”) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明酸性溶液中,能大量共存的离子组是( )
A. Na+﹑Ca2+﹑Cl-﹑CO32- B. Na+、Ca2+、HCO3-、NO3-
C. Cu2+﹑Cl-﹑Ca2+﹑NO3- D. NO3-﹑Na+﹑Ca2+﹑Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10﹣9 mol/L
B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7
C.在c(H+):c(OH﹣)=1:1012的溶液中,Na+、I﹣、NO ![]() 、SO42﹣能大量共存
、SO42﹣能大量共存
D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO ![]() )+c(SO
)+c(SO ![]() )+c(HCO
)+c(HCO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验能达到预期目的是( )
A. 检验![]() :先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
:先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
B. 检验NH4+:先滴加NaOH溶液,加热,用湿润蓝色石蕊试纸检验,若变红,则有NH4+
C. 检验Cl—:先滴加AgNO3溶液,再滴加硝酸,若有白色沉淀,则有Cl—
D. 检验![]() :滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有
:滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。

请回答下列问题:
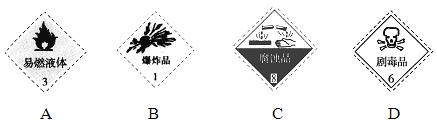
(1)对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。浓硫酸的危险警告标签是_______。
(2)装置A中发生反应的化学方程式为____________________________。
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是_________________(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为_______________________________________;
(5)当D中产生_______________________________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
(6)Ⅰ若为检验浓硫酸与木炭在加热条件下生成的水蒸汽,可在装置__________之间加上一个盛有无水CuSO4的硬质玻璃管。
Ⅱ. Cu与浓硫酸反应可得硫酸铜溶液。某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4![]() 2CuSO4+2H2O。现欲将12.8g铜完全溶解,加蒸馏水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将12.8g铜完全溶解,加蒸馏水后得200 mL溶液。计算:
(7)参加反应的氧气在标准状况下的体积是___________________ L。
(8)所得硫酸铜溶液的物质的量浓度是__________________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com