
| A. | Z2Y2 | B. | X2Y2 | C. | Z2Y | D. | ZYX |
分析 短周期元素X、Y、Z所在的周期数依次增大,Y2-与Z+核外电子层的结构相同,可知二者的离子核外各有10个电子,根据Y与Z的化合价,可知Y、Z分别属于ⅥA和IA族元素,Y的原子序数为8,为O元素,Z的原子序数为11,为Na元素,再根据三者原子序数之和为20,可知X为H元素,三者形成的化合物分别有Na2O、Na2O2、H2O、H2O2以及NaOH,根据化合物类型可判断出化学键类型.
解答 解:短周期元素X、Y、Z所在的周期数依次增大,Y2-与Z+核外电子层的结构相同,可知二者的离子核外各有10个电子,根据Y与Z的化合价,可知Y、Z分别属于ⅥA和IA族元素,Y的原子序数为8,为O元素,Z的原子序数为11,为Na元素,再根据三者原子序数之和为20,可知X为H元素,三者形成的化合物分别有Na2O、Na2O2、H2O、H2O2以及NaOH.
A.Z2Y2为Na2O2,既含有离子键,又含有非极性共价键,故A选;
B.X2Y2为H2O2,同时存在极性和非极性共价键,不含离子键,故B不选;
C.Z2Y为Na2O,只含离子键,故C不选;
D.ZYX为NaOH,含有离子键和极性共价键,故D不选;
故选A.
点评 本题主要考查结构与位置关系、原子核外电子排布及化学键的有关知识,注重原子结构与元素在周期表中位置的关系,题目难度不大.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
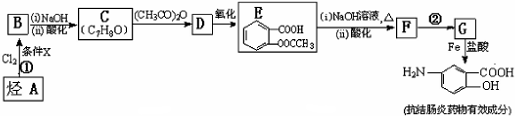
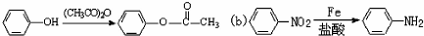
 ;
;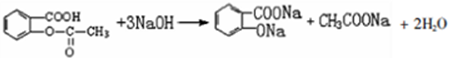 ;
;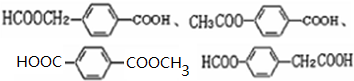 ;
;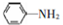 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物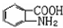 的合成路线
的合成路线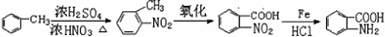 ..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
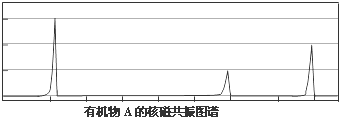
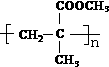 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、写出C-的电子式
、写出C-的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 电解质为NH4Cl的锌锰干电池比电解质KOH锌锰干电池使用寿命长 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:17 | B. | 3:2 | C. | 12:1 | D. | 7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com