
����Ŀ����̼���ó�Ϊ����һ���µ��������������̼�IJ�����������Դ�����һ����Ҫ�о����������������й�ͼʾ����ѧ֪ʶ�ش�
I����CO2�����������ȡ��ϩ��CO2��g��+3H2��g��![]() 1/2C2H4��g��+2H2O��g����
1/2C2H4��g��+2H2O��g����
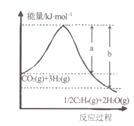
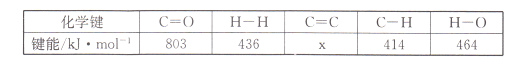
(l)���÷�Ӧ��ϵ�������淴Ӧ���̱仯��ϵ��ͼ��ʾ����÷�Ӧ��H =___________���ú�a��b��ʽ�ӱ�ʾ������֪����ػ�ѧ���ļ������±���ʾ��ʵ����������Ӧ�ġ�H =-152 kJ/mol������е�x= ___��
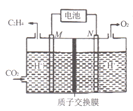
(2)��ϡ����Ϊ�������Һ������̫���ܵ�ؽ�CO2ת��Ϊ��ϩ�Ĺ���ԭ����ͼ��ʾ����M���ϵĵ缫��ӦʽΪ____��
II����CO2�����������ȡ�����ѣ�2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����H =-122.5kJ/mol��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��
CH3OCH3��g��+3H2O��g����H =-122.5kJ/mol��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��
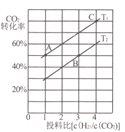
(3)ͼ��T1��T2�ֱ��ʾ��Ӧ�¶ȣ��ж�T1��T2��С��ϵ��������____��ͼ��A��B��C�����Ӧ��ƽ�ⳣ���ֱ�ΪKA��KB��Kc�������ߴ�С�Ĺ�ϵ��____��
(4)T1�¶��£���6molCO2��12molH2����2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬��0��5min�ڵ�ƽ����Ӧ���ʦ�(H2)=_______��ƽ�ⳣ��K=__���г�����ʽ���ɣ���
���𰸡�-��b-a��kJmol-1 764 kJmol-1 2CO2+12e-+12H+=C2H4+4H2O �÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���CO2��ת���ʼ�С������ͼ��֪��Ͷ�ϱ���ͬʱ��T1ƽ��ʱCO2��ת���ʴ���T2����T1<T2 KA=Kc��KB 1.08 mol/��L��min�� ![]()
��������
��1����ͼ֪��Ӧ���������������������������÷�ӦΪ���ȷ�Ӧ�����ݷ�Ӧ����H=��Ӧ��ļ����ܺ�-������ļ����ܺͼ���x��
��2������ͼʾ����M�缫��CO2�����õ��ӵĻ�ԭ��Ӧ����C2H4��M�缫Ϊ������
��3���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ����¶Ȳ��䣬��ѧƽ�ⳣ�����䣬�����¶ȣ���ѧƽ�ⳣ����С��
��4����������ʽ����������ʽ���㷴Ӧ���ʺ�ƽ�ⳣ����
��1����ͼ֪CO2��g��+3H2��g�����е�����������1/2C2H4��g��+2H2O��g�����е����������÷�ӦΪ���ȷ�Ӧ����Ӧ����H=��������е�������-��Ӧ����е�������=-��b-a��kJ/mol����Ӧ����H=��Ӧ��ļ����ܺ�-������ļ����ܺ�=2E��C=O��+3E��H-H��-[1/2E��C=C��+2E��C-H��+4E��H-O��]=2��803kJ/mol+3��436kJ/mol-[1/2x+2��414kJ/mol+
4��464kJ/mol]=-152kJ/mol�����x=764kJ/mol���ʴ�Ϊ��-��b-a��kJmol��1��764 kJmol��1��
��2������ͼʾ����M�缫��CO2�����õ��ӵĻ�ԭ��Ӧ����C2H4��M�缫Ϊ�������缫��ӦʽΪ2CO2+12e-+12H+=C2H4+4H2O���ʴ�Ϊ��2CO2+12e-+12H+=C2H4+4H2O��
��3���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���CO2��ת���ʼ�С������ͼ��֪��Ͷ�ϱ���ͬʱ��T1ƽ��ʱCO2��ת���ʴ���T2����T1![]() T2����ͼ��֪��A��C�¶���ͬ����ѧƽ�ⳣ����ͬ��B���¶ȸ���A��C��KA��KB��Kc���ߴ�С�Ĺ�ϵ��KA=Kc��KB���ʴ�Ϊ���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���CO2��ת���ʼ�С������ͼ��֪��Ͷ�ϱ���ͬʱ��T1ƽ��ʱCO2��ת���ʴ���T2����T1<T2��KA=Kc��KB��
T2����ͼ��֪��A��C�¶���ͬ����ѧƽ�ⳣ����ͬ��B���¶ȸ���A��C��KA��KB��Kc���ߴ�С�Ĺ�ϵ��KA=Kc��KB���ʴ�Ϊ���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���CO2��ת���ʼ�С������ͼ��֪��Ͷ�ϱ���ͬʱ��T1ƽ��ʱCO2��ת���ʴ���T2����T1<T2��KA=Kc��KB��
��4����ͼ��֪����6molCO2��12molH2����2L���ܱ������У�����5min��Ӧ�ﵽƽ��ʱ��CO2��ƽ��ת����Ϊ60%����������ݽ�����������ʽ��
2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g��
CH3OCH3��g��+3H2O��g��
��mol/L�� 3 6 0 0
�䣨mol/L�� 1.8 5.4 0.9 2.7
ƽ��mol/L�� 1.2 0.6 0.9 2.7
��0��5min�ڵ�ƽ����Ӧ���ʦ�(H2)= ��c(H2)/ ��t=5.4 mol/L/5min=1.08 mol/��L��min������ѧƽ�ⳣ��K=c(CH3OCH3)c3(H2O) /[c2(CO2)c6(H2)]=��0.9��2.73��/��1.22��0.66�����ʴ�Ϊ��1.08 mol/��L��min������0.9��2.73��/��1.22��0.66����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������Ԫ�����ڱ���������ȷ���ǣ� ��
A. ���� 6 �����ڣ�16 ���� B. ���� 7 �����ڣ�18 ����
C. ���� 6 �����ڣ�18 ���� D. ���� 7 �����ڣ�16 ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ұ�����ĵ�һ����Ӧԭ��Ϊ2SnO2 + 3C![]() 2Sn + aM��+ CO2��,������˵���д������(����)
2Sn + aM��+ CO2��,������˵���д������(����)
A. ��Ӧ��SnO2����ԭ B. a��ֵΪ3
C. ��Ӧ���������������� D. ÿ����1 mol CO2ת�Ƶ���8 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ѧ����ѧϰ��ͬѧ�Ƕ��������Ļ����������˽�һ���˽⡣
��1������H��C��N��O��K����Ԫ�أ���ѡ�����е�Ԫ��д���������ʵĻ�ѧʽ��
����Ȼ������Ҫ�ɷ�____��
�ڼ�����Ѫ�쵰��ϵ��ж�����____��
���ܹ�������������____��
�ܿ������Ϸʵ������____��
��2����ͼ��ij��ʯ��Ʒ�и���Ԫ�غ����ı���ͼ��

�ٸ���ʯ�к�____�ַǽ���Ԫ�أ����к�����������____Ԫ�ء�
�������ӵĽṹʾ��ͼΪ ����X��____��
����X��____��
�۴���ʯ��Ʒ�в����ܺ��еĻ�������____��
A��CaCO3 B��K2SO4 C��Al2O3 D��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����E��F�����ܱ������У���һ�������·�����Ӧ��E(g)��F(s)![]() 2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��
2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��

�� b��f�� �� 915�桢2.0 MPaʱE��ת����Ϊ60% �� ����ѹǿƽ������ �� K(1 000��)��K(810��) �����١�������ȷ����(����)
A. 4�� B. 3�� C. 2�� D. 1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ӹ����˵�������ӷ���ʽ����д������ȷ��һ������ ��
�� ����NaOH��Һ�����Һ���ܴ��������������NH4+��Al3+��Cl����SO42��
�� pH=1����Һ���ܴ��������������Fe3+��Mg2+��Cl����SO42��
����ʹ��̪��Һ������Һ���ܴ��������������K+��CO32����Na����S2��
�� ��NH4HCO3��Һ�м�������NaOH��Һ��������NH4+ + OH�� �� NH3��+ H2O
�� ��ʳ���ܽ�ˮ����CaCO3 + 2H+ = Ca2+ + CO2��+ H2O
�� ������������Һ�е�������������Һ��pH = 7��Ba2+ + 2OH�� + 2H+ + SO42�� = BaSO4�� + 2H2O
�� ��FeCl3��Һ��ʴͭ��·����2Fe3+ + Cu= 2Fe2+ + Cu2+
A.�٢ۢݢ�B.�ڢۢޢ�C.�ڢܢݢ�D.�ۢܢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ijУ��ѧС����ʵ��ķ�������̽����ʵ��ҩƷ��ͭ������þ��0.5 mol L-1H2SO4��Һ��2 mol L-1 H2SO4��Һ����ͬѧ�о���ʵ�鱨�����±���
ʵ�鲽�� | ���� | ���� |
���ֱ�ȡ�������2 mol L-1 ��������Һ����֧�Թ��� | ��Ӧ������ þ>����ͭ����Ӧ | ����������Խ���ã���Ӧ����Խ�� |
��1�� ��ͬѧ����ʵ�鲽����Ϊ______________________��
��2�� ��ͬѧ��ʵ��Ŀ����__________________________��
Ҫ�ó���ȷ��ʵ����ۣ�����Ҫ���Ƶ�ʵ��������_____________��
��ͬѧΪ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼ��ʾװ�ý���ʵ����

��3����ͬѧ��ʵ����Ӧ�òⶨ��������_________________��
��4����ͬѧ��ɸ�ʵ��Ӧѡ�õ�ʵ��ҩƷ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�����������ȷ����

A. a��b������ʱ����Ƭ�ϲ����н���ͭ����
B. ����a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ���dz��ɫ
C. a��b�õ�������ʱ�����������b��a
D. a��b�õ�������ʱ��FeƬ�Ϸ���������Ӧ����Һ��SO42-��ͭ�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ʊ�������ķ�ӦΪ��3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ��H<0����0.3 molSiCl4 ��һ���� N2��H2 Ͷ��2 L��Ӧ������ֻ�ı��¶��������Si3N4�������仯���±���
Si3N4(s)+12HCl(g) ��H<0����0.3 molSiCl4 ��һ���� N2��H2 Ͷ��2 L��Ӧ������ֻ�ı��¶��������Si3N4�������仯���±���
ʱ��/min ����/g �� ��/�� | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
250 | 0.00 | 1.52 | 2.80 | 3.71 | 4.73 | 5.60 | 5.60 |
300 | 0.00 | 2.13 | 3.45 | 4.48 | 4.48 | 4.48 | 4.48 |
����˵����ȷ����
A. 250��,ǰ 2min�� Si3N4 ��ƽ����Ӧ����Ϊ 0.02 mol��L��1��min��1
B. ��Ӧ�ﵽƽ��ʱ�� �����¶��� N2 �� H2 ��ת����֮����ͬ
C. �ﵽƽ��ǰ�� 300�������ķ�Ӧ���ʱ� 250��죻 ƽ��� 300��� 250����
D. ��Ӧ�ﵽƽ��ʱ�� ���������·�Ӧ�ų�������һ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com