
| A. | 4.8g滤渣是由3.2g铜和1.6g铁组成 | B. | ω=14.7 | ||
| C. | 反应过程中产生的氢气是2.24L | D. | 滤液是20.88%的硫酸亚铁溶液 |
分析 根据已有的知识进行分析,在化学反应前后,铜元素的质量不变,氧化铜能与硫酸反应生成硫酸铜和水,而铁能与硫酸铜反应生成硫酸亚铁和铜,据此解答即可.
解答 解:所得滤渣中铜元素的质量与氧化铜中铜元素的质量相等,则铜的质量为:4g×$\frac{64}{80}$=3.2g,故滤渣中铁的质量为4.8g-3.2g=1.6g
设生成3.2g铜需要铁的质量为x,生成硫酸亚铁的质量为y
Fe+CuSO4=FeSO4+Cu
56 64
x 3.2g
$\frac{56}{x}=\frac{64}{3.2}$
x=2.8g
而剩余的滤渣中含铁的质量是1.6g,故与硫酸反应的铁的质量为:10g-2.8g-1.6g=5.6g
设生成的氢气的质量为y
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g z
$\frac{56}{5.2g}=\frac{2}{z}$ z=0.2g
反应硫酸全部转化生成硫酸亚铁,根据铁、硫酸和硫酸亚铁的质量关系,设消耗的硫酸的质量为a,生成的硫酸亚铁的质量为b
Fe--H2SO4--FeSO4
56 98 152
8.4g a b
$\frac{56}{8.4}=\frac{98}{a}=\frac{152}{b}$ a=14.7,b≈22.8g
A、根据计算可知,4.8g滤渣是由3.2g铜和1.6g铁组成,故A正确;
B、硫酸溶液的质量分数为:$\frac{14.7}{100}$×100%=14.7%,故B正确;
C、状况不知,无法求体积,故C错误;
D、硫酸亚铁溶液的质量分数为:$\frac{22.8g}{100g+10g+4g-0.2g-4.8g}×100%$=20.9%,故D错误;
故选AB.
点评 本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的信息结合质量守恒定律进行.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出CO2的电子式
,写出CO2的电子式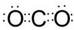 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 多肽、油脂、淀粉均为酯类 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 福尔马林、漂粉精、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g | |
| B. | 学生实验测定硫酸铜晶体中结晶水含量时,通常至少称量4次 | |
| C. | 酸碱中和滴定实验中只能用标准液滴定待测液 | |
| D. | 分液时,分液漏斗中下层液体从下口放出后,换一容器再从下口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
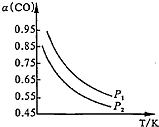 工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:| A. | 由图可知:Pl<P2 | |
| B. | 升高温度反应Ⅱ的平衡常数减小 | |
| C. | 恒压绝热下向反应器中加Ar(g).反应Ⅲ一定不移动 | |
| D. | 其它条件不变,起始时改变CO和CO2比例,平衡时CO转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪烃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可鉴别乙醇和乙醚 | |
| B. | 用新制的银氨溶液可鉴别甲酸乙酯和丙醛 | |
| C. | 用水可鉴别苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可鉴别己烷和3-己烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com