
分析 根据相同条件下气体体积之比等于物质的量之比,由混合气体1L充分燃烧后得到同温同压下2.5LCO2和3.5L水蒸气,可知混合气体的平均分子式为C2.5H7,碳原子数小于2.5的烷烃有甲烷和乙烷,则另一种对应烷烃为丙烷和丁烷,结合平均分子式计算出二者的体积.
解答 解:同条件下气体体积之比等于物质的量之比,由混合气体1L充分燃烧后得到同温同压下2.5LCO2和3.5L水蒸气,可知混合气体的平均分子式为C2.5H7,
烷烃中碳原子数小于2.5的有甲烷和乙烷,
当一种烷烃为甲烷时,另一种烷烃为丙烷,设甲烷体积为x,乙烷体积为y,则$\frac{x+3y}{x+y}$=2.5,整理可得:x+y=1:3,则混合气体中含有甲烷体积为:1L×$\frac{1}{4}$=0.25L,含有丙烷体积为0.75L;
但一种烷烃为乙烷时,另一种烷烃为丁烷,设乙烷体积为x、丁烷体积为y,则$\frac{2x+4y}{x+y}$=2.5,整理可得:x+y=3:1,则混合气体中含有乙烷的体积为:1L×$\frac{3}{4}$=0.75L,含有丁烷的体积为0.25L,
故答案为:A为甲烷、B为丙烷时,二者体积分别为0.25L、0.75L;当A为乙烷、B为丁烷时,二者体积分别为0.75L、0.25L.
点评 本题考查了混合物反应的计算、有机物分子式的确定,题目难度中等,明确平均分子式的含义为解答关键,注意掌握平均值法、讨论法在化学计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氯气所含的原子数目为NA | |
| B. | 标准状况下,1.12LO2和1.12 L CO2均含有0.1NA氧原子 | |
| C. | 标准状况下,22.4L空气含有NA个单质分子 | |
| D. | 标准状况下,22.4LH2O含有NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.
如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
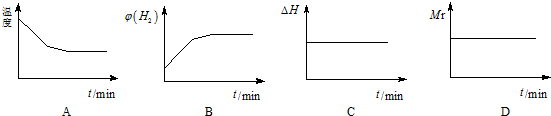
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3 n | n | 0 | 放出热量a kJ |
| Ⅱ | 3 n | 2 n | 0 | 放出热量b kJ |
| Ⅲ | 6 n | 2 n | 0 | 放出热量c kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com