
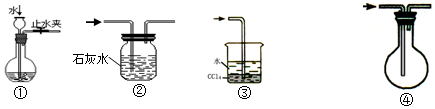
| A. | 装置①可用于检查装置的气密性 | |
| B. | 装置②可用于除去CO中混有的少量CO2 | |
| C. | 装置③可用于安全吸收极易溶于水的氯化氢来制盐酸 | |
| D. | 装置④可用于排空气收集CO |
分析 A.关闭止水夹,利用液差法可检验气密性;
B.二氧化碳与石灰水反应,而CO不能;
C.HCl极易溶于水,四氯化碳的密度比水的密度大,与水分层,可隔绝气体与水;
D.CO的密度与空气的密度接近.
解答 解:A.关闭止水夹,注入水,当烧瓶中液面与长颈漏斗导管中液面的高度在一段时间不变,则气密性良好,故A正确;
B.二氧化碳与石灰水反应,而CO不能,气体长进短出可除杂,故B正确;
C.HCl极易溶于水,四氯化碳的密度比水的密度大,与水分层,可隔绝气体与水,装置可防止倒吸,故C正确;
D.CO的密度与空气的密度接近,不能利用排空气法收集,应选排水法,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握气密性检验、混合物分离提纯、气体的收集、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验技能及实验的评价性分析,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 三种酸的酸性为HX<HY<HZ | |
| B. | 物质的量浓度相同的三种盐的水溶液中,NaZ的溶液中,水的电离程度最大 | |
| C. | pH值相同的三种酸的水溶液,恰好中和时所耗NaOH的物质的量为HX<HY<HZ | |
| D. | 物质的量浓度相同的HZ和NaX能发生HZ+NaX=HX+NaZ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
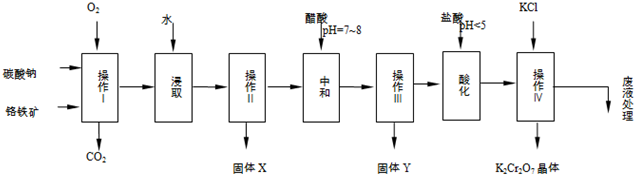
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
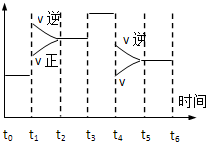 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )| A. | t0~t1 | B. | t2~t3 | C. | t3~t4 | D. | t5~t6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
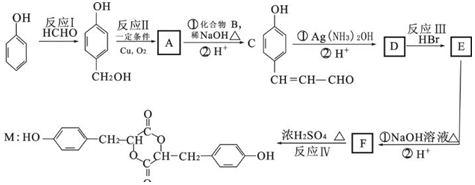
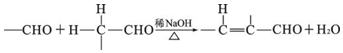
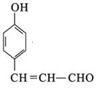 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O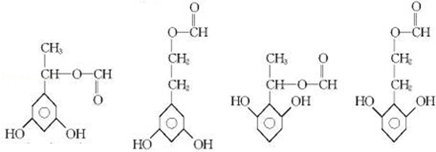 种.
种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
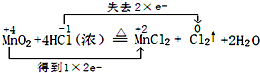 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
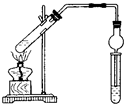 用图所示实验装置制取乙酸乙酯.回答以下问题:
用图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com