
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:
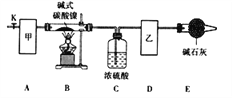
(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。

(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中________________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气,其目的是______________________________。
(3)装置A的作用是________________________________________________,若没有装置E,则会使x/z__________(填写“偏大”或“偏小”或“无影响”)。
(4)实验前后测得下表所示数据:
装置B中样品质量/g | 装置C 质量/g | 装置D质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍分解的化学方程式为_______。
(5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。
【答案】 c c 不再有气泡产生 将装置中残留的气体产物吹入吸收装置中 吸收空气中的CO2和水蒸气 偏小 Ni3(OH)4CO3·4H2O=3NiO+6H2O+CO2 在装置B、C之间连接一个安全瓶(或其它合理答案均可给分)
【解析】本题考查实验方案设计与评价,(1)本题实验目的是测定碱式碳酸镍的组成,根据信息,300℃以上时分解生成3种氧化物,这三种氧化物分别是NiO、CO2、H2O,需要测CO2和H2O的质量,因此必须让其全部被吸收,根据(2),甲装置的作用是吸收空气中CO2和H2O,甲装置应是c,B装置应是加热碱式碳酸镍,C装置应是吸收产生H2O,D装置应是吸收产生CO2,防止外界中CO2和H2O进入装置D,对测量产生影响,因此E的作用是防止空气中的CO2和H2O进入D装置,故乙装置选c;(2)根据上述分析,当装置C中不再有气泡产生,说明反应完全,打开活塞K,缓慢通入空气的目的是让装置中残留的气体产物被C和D装置全部吸收;(3)根据(1)的分析,装置A的作用是吸收空气中的CO2和水蒸气;装置E的作用是防止外界中CO2和H2O进入装置D,如果没有此装置,D装置吸收空气中CO2和水,造成CO2的质量增大,根据元素守恒,x/z偏大;(4)装置C质量增重(133.08-132.00)g=1.08g,产生水的质量为1.08g,合0.06mol,装置D增重的质量是CO2的质量,即为(41.44-41.00)g=0.44g,合0.01mol,装置B中反应后的物质是NiO,其质量为2.25g,合0.03mol,化合价代数和为0,因此推出OH-物质的量为0.04mol,根据H原子守恒推出H2O的物质的量为0.04mol,因此x:y:z:n=0.03:0.04:0.01:0.04=3:4:1:4,即碱式碳酸镍的化学式为Ni3(OH)4CO3·4H2O,碱式碳酸镍受热分解化学方程式为:Ni3(OH)4CO3·4H2O ![]() 3NiO+6H2O+CO2;(5)根据信息,应在装置B、C之间连接一个安全瓶。
3NiO+6H2O+CO2;(5)根据信息,应在装置B、C之间连接一个安全瓶。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库。海水综合利用的部分流程如下:

已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。
(1)操作A是___________(填实验基本操作名称),粗盐中常含 Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、______ 、______、盐酸试剂来进行提纯。
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)已知母液中的主要成分如下表:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
理论上,1m3母液中最多可得到Mg(OH)2的质量为___________。
(4)利用下图所示装置模拟工业上从母液中提取溴,在B瓶中得到较浓的溴水。

实验方案为:关闭b、d,打开a、c,由a向A中缓慢通入________至反应完全,发生反应的的离子方程式是_________________________;再关闭a、c,打开b、d、e,由b向A中鼓入足量_________,同时由 e 向B中通入足量_________;关闭b、e,打开a,再由a 向B中缓缓鼓入足量___________,即可在B中得到较浓的溴水。(本实验中须使用的试剂有:SO2、Cl2、热空气) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液与20mL 1 molL—1 NaNO3溶液中NO3- 物质的量浓度相等的
A. 10 mL 1 molL-1 Mg(NO3)2溶液 B. 5 mL 1molL-1 Al(NO3)3溶液
C. 10 mL 0.5 molL-1 Ag NO3溶液 D. 10 mL 0.5molL-1 Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g) + 3H2 (g)![]() 2NH3 (g) ΔH <0。
2NH3 (g) ΔH <0。
(1)达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
(2)达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
(3)达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
(4)达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
(5)保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
(6)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
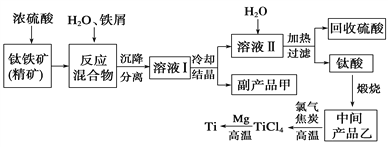
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种重要的有机化工原料有机物X,如图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
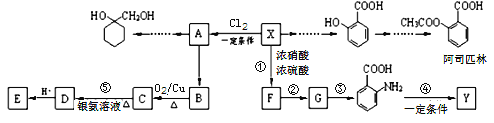
已知:①X为芳香烃,其相对分子质量为92
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为__________________;
(2)![]() 中官能团的名称为___________________________;
中官能团的名称为___________________________;
(3)反应③的反应类型是_____;已知A为一氯代物,则E的结构简式为____________;
(4)反应④的化学方程式为________________________________________________;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有_______种:
①含有苯环;②既不能发生水解反应,也不能发生银镜反应;③1mol该有机物能与2molNaHCO3完全反应.
(6)请写出以A为原料制备![]() 的合成路线流程图(无机试剂任用)______。
的合成路线流程图(无机试剂任用)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
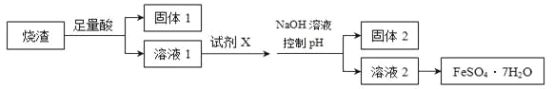
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:( )
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,汽车尾气已成为许多大城市空气的主要污染源.汽车尾气中含有CO,NO等多种污染物.
(1)汽车燃料中一般不含氮元素,尾气中NO是如何产生的?说明原因(用化学方程式表示) .
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2 , 该反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com