
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | C5H10中只有三种属于直链烯烃的同分异构体(包括空间异构) | |
| D. | 含两个-COOCH3的有机物(C7H12O4)属于酯的同分异构体多于4种 |
分析 A、含有3个碳原子的烷基为丙基、异丙基两种,甲苯苯环上有3种氢原子,分别处于甲基的邻、间、对位置上,据此判断;
B、依据分子式计算不饱和度,然后判断即可;
C、C5H10的烃,不饱和度为1,直链烯烃不具有支链,据此解答即可;
D、两个 基团在端点,故可写出其满足条件的同分异构体.
基团在端点,故可写出其满足条件的同分异构体.
解答 解:A、含有3个碳原子的烷基为丙基、异丙基两种,甲苯苯环上有3种氢原子,分别处于甲基的邻、间、对位置上,所以甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,同分异构体最多有3×2=6种,故A错误;
B、分子式为C8H10的芳香烃,分子中含有1个苯环,其不饱和度=$\frac{2×8+2-10}{2}$=4,故侧链为烷基,若有1个侧链,为-CH2-CH3,有一种;若有2个侧链,为-CH3,有邻、间、对三种,故符合条件的结构共有4种,故B错误;
C、戊烷的同分异构体直链的为CH3-CH2-CH2-CH2-CH3,相应烯烃有CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3,其中CH3-CH═CH-CH2-CH3有2种顺反异构,即有3种异构,故C正确;
D、两个 基团在端点,故可写出其满足条件的同分异构体,含两个-COOCH3基团的C的同分异构体共有4种,
基团在端点,故可写出其满足条件的同分异构体,含两个-COOCH3基团的C的同分异构体共有4种,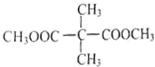 ,CH3OOCCH2CH2CH2COOCH3,CH3OOCCH2CH(CH3)CH2COOCH3,CH3CH2CH(COOCH3)2,故D错误,故选C.
,CH3OOCCH2CH2CH2COOCH3,CH3OOCCH2CH(CH3)CH2COOCH3,CH3CH2CH(COOCH3)2,故D错误,故选C.
点评 本题主要考查的是同分异构体个数的判断,熟练掌握碳原子数小于5的烷烃基的个数是解决本题的关键,难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:多选题
| A. | 元素周期表共有七个周期 | |
| B. | 元素周期表共有18个族 | |
| C. | 所含元素种数最多的族是 VIII族 | |
| D. | 第三周期元素的原子核外都有三个电子层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
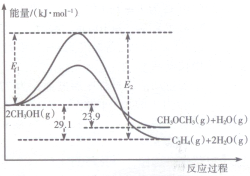 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)}$ | |
| C. | 2c1<1.5 | |
| D. | 2ρ1=ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1 mol.L-1SO2的溶液.中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、N03-、SO42- | |
| C. | $\frac{C{(H}^{+})}{C({OH}^{-})}$=10-12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
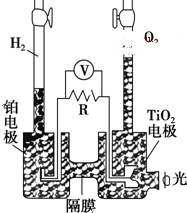 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| B. | 该装置工作时,TiO2电极附近溶液的pH变大 | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18ml | B. | 大于18ml | C. | 小于18ml | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com