
| A. | 氧原子数 | B. | 质量 | C. | 原子数 | D. | 体积 |
分析 同温同压下,等物质的量的NO和NO2具有相同的体积,每个分子中含有氧原子数目、原子数目不等,则含有氧原子总数、原子总数不相等,二者摩尔质量不相等,则二者质量不相等.
解答 解:A.等物质的量的NO和NO2含有氧原子数目之比为1:2,含有氧原子数目不相等,故A错误;
B.二者摩尔质量不相等,根据m=nM可知,二者质量不相等,故B错误;
C.等物质的量的NO和NO2含有原子数目之比为2:3,含有原子数目不相等,故C错误;
D.同温同压下,气体摩尔体积相等,则等物质的量的NO和NO2占有的体积相等,故D正确,
故选:D.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
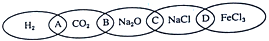
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 向品红溶液中同时通入Cl2、SO2,漂白效果会更好 | |
| B. | 加热可判断品红褪色是通入SO2还是通入Cl2引起的 | |
| C. | “无色化合物”分子中,19个碳原子都可能处在同一平面上 | |
| D. | 品红分子结构中,所有原子不可能处在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中FeSO4既作氧化剂,又作还原剂 | |
| B. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为1×6.02×1023 | |
| D. | 该反应生成的气体通入足量BaCl2溶液中,可得到BaSO3和BaSO4两种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
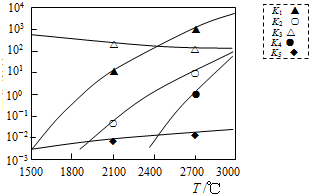
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙试液变红的溶液中:Na+、K+、MnO4-、I- | |
| B. | 含Br-、K+、Na+、HSO3-的溶液,通入SO2后这些离子仍能大量共存 | |
| C. | 含K+、Na+、NO3-、CH3COO-的溶液中c(H+)=$\sqrt{{K}_{W}}$ | |
| D. | 在水电离出的c(H+)=10-13mol•L-1 的溶液中:NH4+、AlO2-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用于现代通讯的光导纤维的主要成分是高纯度的硅 | |
| B. | 工业上可以用TiCl4+4Na$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl反应冶炼钛 | |
| C. | 与生铁相比,纯铁更难被腐蚀 | |
| D. | 在医疗上碳酸氢钠可用于治疗胃酸过多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com