
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
分析 a.每个碳原子含有2个碳碳键;
b.氢氧化铝胶体粒子为氢氧化铝的聚集体;
c.Na2O2与水的反应为歧化反应,反应中O元素化合价由-1价变化为0价;
d.溶液体积未知;
e.气体摩尔体积使用对象为气体;
f.质量转化为物质的量,结合1个过氧化氢含有18个电子解答;
g.二氧化硫与氧气反应生成三氧化硫为可逆反应,可逆反应不能进行到底;
h.铝离子部分水解,导致溶液中阳离子数目增多.
解答 解:a.12g 金刚石的物质的量为1mol,而1mol金刚石中含2mol碳碳键即2NA个,故a正确;
b.一个氢氧化铝胶粒是多个氢氧化铝的聚集体,故形成的胶粒的个数小于NA个,故b错误;
c.Na2O2与水的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故c正确;
d.NH4NO3溶液的体积不明确,故溶液中的氮原子的物质的量无法计算,故d错误;
e.标准状况下,C6H14为液态,故2.24LC6H14的物质的量大于0.1mol,则含有的原子的物质的量大于2mol即2NA个,故e正确;
f.17gH2O2的物质的量为0.5mol,而1mol双氧水中含18mol电子,故0.5mol双氧水中含9mol电子即9NA个,故f正确;
g.SO2与 O2的反应为可逆反应,不能进行彻底,故转移的电子数小于4NA个,故g错误;
h.Al3+是弱碱阳离子,在溶液中会水解,导致阳离子的个数增多,故溶液中的阳离子的个数多于0.1NA个,故h正确;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题题量较大,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向25mL冷水与沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
| C | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 向饱和Na2CO3溶液中加入BaSO4固体,振荡、过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)>Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
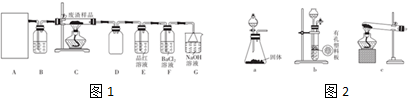
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗酸性KMnO4溶液的体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
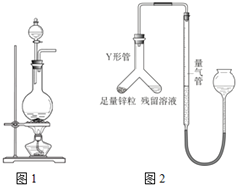 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 | |
| B. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| C. | NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | |
| D. | 0.1 mol/L CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中c(OH-)都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
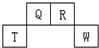 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )| A. | 原子半径Q>R>T | |
| B. | 原子序数比R多1的元素只能形成一种氢化物 | |
| C. | W原子得电子能力强于Q原子,且可形成共价化合物QW2 | |
| D. | 与W同一主族的下一周期元素不可作为半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含3.2amolHNO3的稀溶液中,加入2amol铁粉:5Fe+4NO3-+16H+═3Fe2++2Fe3++4NO↑+8H2O | |
| B. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| C. | 泡沫灭火器灭火时发生的反应:2Al3++3CO32-+H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 将AgCl白色沉淀加入Na2S溶液中反应:2AgCl+S2-═Ag2S↓+2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com