
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2molL﹣1稀硫酸,微热使样品溶解.再加入30mL水加热,用0.2000molL﹣1 KMnO4溶液滴定至终点,消耗8.00mLKMnO4溶液.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500molL﹣1 Na2S2O3标准溶液滴定至终点,消耗8.00mLNa2S2O3溶液.
已知涉及的部分反应的离子方程式为:
步骤a:2MnO4﹣+5C2O42﹣+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I﹣=2CuI↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
(1)已知室温下CuI的Ksp=1.27×10﹣12 , 欲使溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , 应保持溶液中c(I﹣)≥molL﹣1 .
(2)MnO4﹣在酸性条件下,加热能分解为O2 , 同时生成Mn2+ .
写出该反应的离子方程式为 .
若无此加热操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”).
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 .
(4)通过计算确定样品晶体的组成.
【答案】
(1)1.27×10﹣6
(2)4MnO4﹣+12H+ ![]() 4Mn2++5O2↑+6H2O;偏高
4Mn2++5O2↑+6H2O;偏高
(3)溶液由蓝色变为无色,且半分钟内不变色
(4)解:根据反应2MnO4﹣+5C2O42﹣+16H+=2Mn2++8H2O+10CO2↑、2Cu2++4I﹣=2CuI↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
可得关系式:2MnO4﹣~5C2O42﹣
2 5
0.2×8×10﹣3mol n(C2O42﹣)
2S2O32﹣~I2~2Cu2+
2 2
0.25×8×10﹣3mol n(Cu2+)
所以n(C2O42﹣)=4×10﹣3mol,
n(Cu2+)=2×10﹣3mol,
根据电荷守恒原理:n(K+)=2n(C2O42﹣)﹣2n(Cu2+)=4×10﹣3mol
根据质量守恒原理:m(H2O)=0.6720﹣39×4×10﹣3﹣64×2×10﹣3﹣88×4×10﹣3=0.036g
n(H2O)=2×10﹣3,n (K+):n(Cu2+):n(C2O42﹣):n (H2O)=2:1:2:1,
所以样品晶体组成是:K2Cu(C2O4)2H2O,
答:该样品晶体的化学式为:K2Cu(C2O4)2H2O.
【解析】解:(1)CuI的Ksp=1.27×10﹣12=c(Cu+)c(I﹣),c(I﹣)= ![]() =
= ![]() ,由于溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , c(I﹣)≥1.27×10﹣6 , 所以答案是:1.27×10﹣6;(2)锰元素化合价+7→+2,降低了5价,生成氧气,氧元素化合价﹣2→0,升高了2×2=4,所以锰离子前配4,氧气前配5,再利用观察法配平其它物质,反应的离子方程式是:4MnO4﹣+12H+
,由于溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , c(I﹣)≥1.27×10﹣6 , 所以答案是:1.27×10﹣6;(2)锰元素化合价+7→+2,降低了5价,生成氧气,氧元素化合价﹣2→0,升高了2×2=4,所以锰离子前配4,氧气前配5,再利用观察法配平其它物质,反应的离子方程式是:4MnO4﹣+12H+ ![]() 4Mn2++5O2↑+6H2O;若不加热除去高锰酸根离子,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,测定铜离子含量偏高,所以答案是:4MnO4﹣+12H+
4Mn2++5O2↑+6H2O;若不加热除去高锰酸根离子,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,测定铜离子含量偏高,所以答案是:4MnO4﹣+12H+ ![]() 4Mn2++5O2↑+6H2O;偏高;(3)根据反应I2+2S2O32﹣=2I﹣+S4O62﹣ , 当反应结束时,溶液的蓝色消失变成无色溶液,所以滴定终点是:溶液由蓝色变为无色,且半分钟内不变色,所以答案是:溶液由蓝色变为无色,且半分钟内不变色;
4Mn2++5O2↑+6H2O;偏高;(3)根据反应I2+2S2O32﹣=2I﹣+S4O62﹣ , 当反应结束时,溶液的蓝色消失变成无色溶液,所以滴定终点是:溶液由蓝色变为无色,且半分钟内不变色,所以答案是:溶液由蓝色变为无色,且半分钟内不变色;


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是(填字母序号).
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2 . 
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为、 .
②CaSO4可以调节水泥的硬化时间.尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 .
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
A.在常温常压下,2.24L NH3与1.8g H2O,所含的质子数均为NA
B.在常温常压下,1mol Cl2与足量的NaOH溶液完全反应,转移电子2NA
C.在标准状况下,64g SO2 中含有的原子数为3NA
D.在标准状况下,11.2L H2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为(用元素符号表示).
②M是含有键的分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为 , W分子的空间构型为 .
⑤AB﹣离子中和B2分子的π键数目比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题: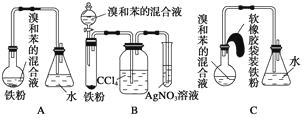
(1)写出三个装置中所共同发生的两个反应的化学方程式:;。
写出B中盛有AgNO3溶液的试管中所发生反应的化学方程式:。
(2)装置A和C均采用了长玻璃导管,其作用是。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是;
应对装置C进行的操作是。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是。
(5)B中采用了洗气瓶吸收装置,其作用是 , 反应后洗气瓶中可能出现的现象是。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
A.H2C2O4在反应中被还原
B.1 molKClO3参加反应有2mol电子转移
C.ClO2是氧化产物
D.KClO3在反应中得到电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答问题
(1)电解池就是把能转化能的装置
(2)常温下KW数值= .
(3)常温下,某溶液中的c(H+)=5.0×10﹣7 molL﹣1 , 则此时c(OH﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1molL﹣1氢氧化钠溶液与0.06molL﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2 , 某小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图: 
Ⅰ.打开弹簧夹K1~K4 , 通入一段时间N2 , 再将T型导管插入B中,继续通入N2 , 然后关闭K1、K3、K4 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2 .
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3 .
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是 .
(2)棉花中浸润的溶液为 . 作用是
(3)A中发生反应的化学方程式 .
(4)导致步骤Ⅲ中溶液变黄的离子反应是 . 用(写试剂化学式)检验氧化产物,现象是 .
(5)能说明氧化性Fe3+>SO2的离子方程式是 .
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是(填“甲”“乙”“丙”).
过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com