
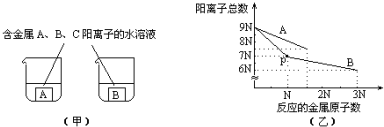
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
分析 根据图象乙可知:B的活泼性大于A、B,A能够与A、B、C的阳离子中的一种发生反应,则与金属A发生反应的只能为C,据此可判断金属A、B、C的活泼性;
加入金属B后,C的阳离子优先反应,3N个C的阳离子总消耗了N个B金属原子,然后A的阳离子反应,3N个A的阳离子反应消耗了2N个B原子,据此可判断A阳离子与B阳离子所带电荷大小;P点时溶液中含有4N个B离子、3N个A离子,据此可知$\frac{B的阳离子数}{A的阳离子数}$.
解答 解:根据图象乙可知,B的活泼性大于A、B,A能够与A、B、C的阳离子中的一种发生反应,则与金属A发生反应的只能为C,则金属的活泼性:B>A>C;
加入金属B后,C的阳离子优先反应,3N个C的阳离子总消耗了N个B金属原子,然后A的阳离子反应,3N个A的阳离子反应消耗了2N个B原子,则A阳离子所带电荷小于B;
P点时溶液中含有4N个B离子、3N个A离子,则$\frac{B的阳离子数}{A的阳离子数}$=$\frac{4}{3}$,
根据分析可知,正确的为②③,
故选D.
点评 本题考查了金属活泼性强弱比较,题目难度中等,明确图象乙中曲线变化的含义为解答关键,注意熟练掌握常见金属的活泼性及比较方法,试题培养了学生的分析能力及灵活应用能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
向2mL0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 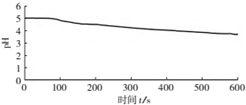 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 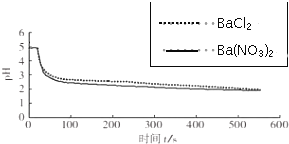 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径C>D>E | |
| B. | A2E6分子中各原子均满足8电子结构 | |
| C. | 气态氢化物的稳定性HmE>HnD | |
| D. | B、C形成的化合物中只可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | H+、Na+、ClO-、Cl- | ||
| C. | K+、HCO3-、Cl-、OH- | D. | Na+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
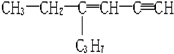 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )| A. | 5,6,4 | B. | 5,3,6 | C. | 5,4,8 | D. | 5,3,5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 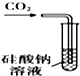 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 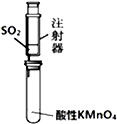 乙装置:可用来检验二氧化硫气体 | |
| C. | 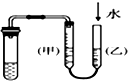 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. |  丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 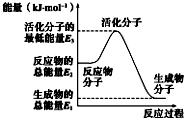 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | N2的燃烧热为180kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和 3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和 6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com