
只给出表中甲和乙对应的量,不能用来求物质的量的是( )
甲 | 乙 | |
A | 物质A的分子数 | 一个A分子的质量 |
B | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
C | 固体体积 | 固体密度 |
D | 非标准状况下物质的质量 | 物质的摩尔质量 |
科目:高中化学 来源:2016届黑龙江省高三第三次月考理综化学试卷(解析版) 题型:填空题
条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I. N2(g)+3H2(g) 2NH3(g)△H=-90.0kJ/mol
2NH3(g)△H=-90.0kJ/mol
II. 2N2(g)+6H2O(l) 4NH3(g)+3O2(g)△H=+1530.0kJ/mol
4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式 。
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如图(图中所示数据均为初始物理量)
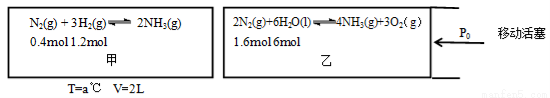
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解)
①该条件下甲容器中的K= ;平衡时,甲的压强P平= (用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= ;
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
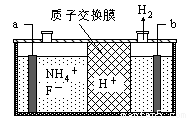
a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知 N2O4(g) 2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
①25℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
②0℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
a.加深 b.变浅 c. 不变 d.无法判断
(5)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s) Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌第二中学高三上第三次考试理综化学试卷(解析版) 题型:填空题
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al2O3):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H= -204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H= -204.7kJ/mol。
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是 。
A.CO和H2的物质的量浓度比是1:2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol,则△H2= 。
(3)复合催化剂的制备方法之一是Na2 CO3共沉淀法:制备1 mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液。然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1 mol/L的Na2CO3水溶液,70℃下搅拌混合。沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时。请写出上述过程中硝酸铝与Na2CO3水溶液反应的离子方程式: 。
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通入DME的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁葫芦岛第一高级中学高三上期中考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式表示正确的是( )
A.H2O2溶液与酸性KMnO4溶液反应:2MnO4-+3H2O2+6H+=2Mn2++6H2O+4O2↑
B.向Fe(NO3)3溶液中加入过量的HI溶液:2 NO3-+8H++6I-=3I2+2NO↑+4H2O
C.少量SO2通入碳酸钠溶液中:CO32-+SO2=CO2+SO32-
D.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列溶液中NO3-的物质的量浓度最大的是( )
A.500 mL 1 mol·L-1的KNO3溶液
B.500 mL 1 mol·L-1的Ba(N O3)2溶液
O3)2溶液
C.1000 mL 0.5 mol·L-1的Mg(NO3)2溶液
D.1000 mL 0.5 mol·L-1的Fe(NO3)3溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:选择题
在酸性溶液中能大量共存,且溶液为无色透明的是
A.K+、Na+、MnO4-、SO42- B.NH4+、K+、NO3-、SO42-
C.Na+、K+、Cl-、CO32- D.Fe3+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:实验题
滴定实验是化学学科中重要的定量实验。 请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是______(填选项字母)
A、滴定终点读数时,俯视滴定管刻度,其他操作正确。
B、盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C、酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D、滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是 。
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”。有一种有机物的键线式也酷似牛,如下图所示,故称为牛式二烯炔醇。下列有关说法不正确的是

A.牛式二烯炔醇含有3种官能团
B.牛式二烯炔醇分子内能发生消去反应
C.1 mol牛式二烯炔醇最多可与6 molBr2发生加成反应
D.牛式二烯炔醇可发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com