
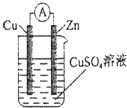
分析 原电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,则负极为Zn,正极为铜,电解质为CuSO4,原电池负极发生氧化反应,正极发生还原反应,总的离子方程式就是自发的氧化还原反应的方程式,以此来解答.
解答 解:不活泼的铜为正极,负极是锌失去电子,生成铜离子,电极反应式为:Zn-2e-=Zn2+,总的离子反应方程式就是锌与铜离子自发的氧化还原反应,即Zn+Cu2+=Zn2++Cu,故答案为:Cu;Zn-2e-=Zn2+;Zn+Cu2+=Zn2++Cu.
点评 本题考查原电池的工作原理,学生应清楚负极发生氧化反应、正极发生还原反应,电极反应式的书写应遵循守恒规律,比较容易.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | C50、N70、C120、C540等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Cl-,Br-,Na+,Cu2+ | |
| B. | 含有大量ClO-的溶液中:SO42-,Cu2+,I-,Fe2+ | |
| C. | 使pH试纸变蓝的溶液中:CO32-,Cl-,F-,K+ | |
| D. | 水电离出c(H+)=1×10-12的溶液中:Ca2+,HCO3-,Mg2+,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用锌与稀硫酸反应时,滴加少量硫酸铜溶液能加快反应速率,因为硫酸铜是催化剂 | |
| B. | 某温度下,一定体积的密闭容器中进行可逆反应:X(g)+Y(g)=Z(g)+W(g)△H>0,平衡后加入一定量X,则△H增大 | |
| C. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| D. | 将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
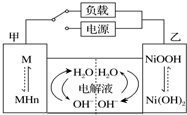 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A. | 在刹车和下坡时,甲电极的电极反应式为:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速时,甲电极周围溶液的pH将减小 | |
| C. | 在上坡或加速时,溶液中的K+向甲电极迁移 | |
| D. | 在刹车和下坡时,乙电极增重 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 | |
| D. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+,Ag+,NO3-,CO32-,SO42- | B. | Fe2+,H+,NO3-,Cl- | ||
| C. | Al3+、NH4+,HCO3-、Cl- | D. | K+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
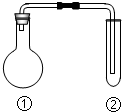 下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )
下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )| ①中的反应 | ②中的现象 | 结论 | |
| A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
| B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
| C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com