

| A. | Cu2+物质的量浓度 | B. | Cl-物质的量浓度 | ||
| C. | Cu极质量 | D. | C(石墨)极质量 |
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{△}^{HBr溶液}$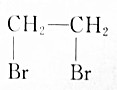 | |
| B. | CH3CH2Br$→_{光照}^{Br_{2}}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{△}^{NaOH醇溶液}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH3$→_{光照}^{Br_{2}}$CH2BrCH2Br | |
| D. | CH3CH2Br$→_{△}^{NaOH醇溶液}$CH2═CH2$\stackrel{溴水}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的 ①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
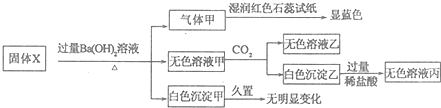
| A. | 白色沉淀乙不一定是Al(OH)3 | B. | 气体甲一定是纯净物 | ||
| C. | 固体X中一定存在(NH4)2SO4、MgCl2 | D. | 固体X中一定存在FeCl2、AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | CCl4、碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
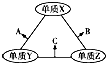 (Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题:
(Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题: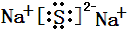 .(用元素符号表示)
.(用元素符号表示)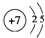 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com