
设NA为阿伏伽德罗常数的值.下列说法正确的是
A. 1mol乙烯分子中含有的共价键数目为4NA
B. 2L 0.5mol•L﹣1(NH4) 2SO4溶液中NH4+离子总数为2NA
C. 1mol FeBr2与足量氯气反应时,转移的电子数为3NA
D. 1mol Na2O2固体中含离子总数为4NA
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2015-2016学年湖南省益阳市高一12月月考化学试卷(解析版) 题型:选择题
下列各组物质只用胶头滴管和试管不能鉴别的是
A.KOH溶液与AlCl3溶液 B.NaAlO2溶液与盐酸
C.NaHCO3溶液与盐酸 D.Na2CO3溶液与盐酸
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上期中化学卷(解析版) 题型:选择题
下列电离方程式错误的是
A.CaCl2 =Ca2++2Cl- B.Ba(OH)2 =Ba2++2OH﹣
C.HNO3=H++NO3- D.NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高一上学期期中测试化学试卷(解析版) 题型:选择题
离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A.①③ B.①④⑤
C.②④⑤ D.①⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省金兰教育合作组织高一上学期期中联考化学试卷(解析版) 题型:选择题
与100mL 0.5mol·L—1NaCl溶液中的Cl-的物质的量浓度相同的是
A.100mL 0.5 mol·L—1MgCl2溶液 B.100mL 0.5mol·L—1KClO3溶液
C.200mL 0.25 mo l·L—1 KCl溶液 D.200mL 0.5mol·L—1 HCl溶液
查看答案和解析>>
科目:高中化学 来源:2016届广西省钦州市钦南区高三上学期期中质量调研测试化学试卷(解析版) 题型:选择题
下列说法正确的是

A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体
B.图Ⅱ装置可验证非金属性:Cl>C>Si
C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3
D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化
查看答案和解析>>
科目:高中化学 来源:2016届广西省钦州市钦南区高三上学期期中质量调研测试化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.Fe3O4与稀硝酸反应的离子方程式为:Fe3O4 + 8H+===Fe2++2Fe3++4H2O
B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3==2Cu2++CO2↑+3H2O
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-== Al(OH)3↓+NH3·H2O+2BaSO4↓
D.少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3—==CaCO3↓+2H2O+CO32—
查看答案和解析>>
科目:高中化学 来源:2016届河南省南阳市高三上学期期中质量评估化学试卷(解析版) 题型:填空题
下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mlL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
A. MgSO4 B.CuSO4 C.AgNO3 D.AlCl3
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南通市高三上学期第一次阶段测化学试卷(解析版) 题型:实验题
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:

已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。
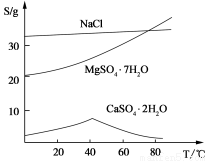
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约 (MgSO4·7H2O式量为246)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com