

分析 (1)燃料电池中,通入燃料的电极是负极,通入氧气的电极是正极,燃料电池的负极上是燃料甲醇发生失电子的氧化反应;
(2)燃料电池的负极上是燃料发生失电子的氧化反应,根据电解质环境来回答;
(3)电解硫酸铜的总反应为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,据串联电路中电子守恒来计算生成的酸的物质的量,再计算氢离子浓度,得出pH;
(4)若a、b均换成铜电极,铜是活性电极,在阳极失电子产生铜离子,阴极是铜离子得电子,进入溶液中的铜离子与阴极消耗的铜离子恰好相等.
解答 解:(1)燃料电池中,通入燃料甲醇的电极是负极,通入氧气的电极是正极,燃料电池的负极上是燃料甲醇发生失电子的氧化反应,电解质环境是酸性,则电极反应为CH3OH-6e-+H2O=CO2↑+6H+,
故答案为:正极;CH3OH-6e-+H2O=CO2↑+6H+;
(2)电解池中,和电源负极相连的极b是阴极,和电源正极相连的a极是阳极,电解硫酸铜溶液,在阴极上是铜离子得电子生成铜,该电极上有紫红色固体析出,
故答案为:石墨电极表面有紫红色固体析出;
(3)在燃料电池的正极上,正极反应为O2↑+4H++4e-=2H2O,当消耗336mL即0.015mol氧气时,转移电子物质的量是0.06mol,电解硫酸铜溶液是放氧生酸型,根据电解方程式2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4~4e-可知转移电子0.06mol时,生成硫酸物质的量是0.03mol,氢离子物质的量为0.06mol,
则$c({H}^{+})=\frac{n({H}^{+})}{V}$=$\frac{0.06mol}{0.6L}$=0.1mol/L,pH=1,
故答案为:1;
(4)若a、b均换成铜电极,则阳极铜失电子生成铜离子,阴极是铜离子得电子析出铜,溶液中的铜离子浓度不变,
故答案为:不变.
点评 本题考查了原电池和电解池的工作原理的应用,注意把握电极名称、电极判断、电极反应、电池反应,题目难度中等,明确电子守恒在计算中的应用是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
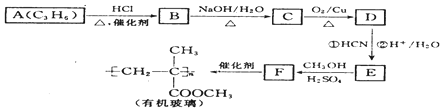
 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$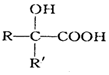 (注:R′可以是H原子)
(注:R′可以是H原子) 是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线
是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线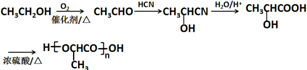 .合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
.合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可使酸性高锰酸钾溶液褪色 | B. | 它能使溴水褪色 | ||
| C. | 它可与银氨溶液反应 | D. | 若催化加氢,最终产物是 C10H20O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g由乙酸和乳酸组成的混合物中所含有的O原子数 | |
| B. | Cu和足量的稀硝酸反应产生7.47 L NO气体时转移的电子数 | |
| C. | 0.25 mol丁烷中含有的非极性键数 | |
| D. | 1 mol FeCl3加入沸水制得的胶体中含有胶体粒子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发煤炭的洁净、高效利用技术,保护生态环境 | |
| B. | 推广CO2的再利用技术,将其合成有价值的化学品 | |
| C. | 利用工业废水灌溉农作物,提高水资源的利用率 | |
| D. | 提高风能、水能、太阳能等可再生清洁能源的使用比例 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N60与N2都是氮的同素异形体 | |
| B. | N60转化为N2属化学变化 | |
| C. | N60的总能量高于N2的总能量 | |
| D. | N60变为 N2的反应是放热反应,说明N60比N2更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
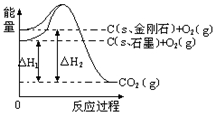
| A. | 石墨和金刚石互为同位素 | |
| B. | 金刚石的总能量比石墨的总能量高1.9 kJ | |
| C. | C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1 | |
| D. | C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com