
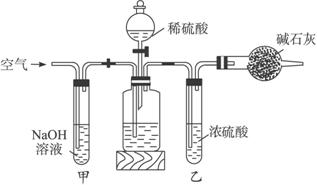
图1-9
(A)在干燥管内填满碱石灰,总质量为m g;
(B)取n g样品装入广口瓶中;
(C)检验装置的气密性;
(D)缓缓鼓入空气数分钟,再称干燥管总质量为w g;
(E)关闭止水夹;
(F)打开止水夹;
(G)缓缓加入稀硫酸至不再产生气体为止;
(H)缓缓鼓入空气数分钟。
(1)正确的操作顺序是(填写序号):C→_______→F________→E_______→G________→D。
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是________________;装置甲的作用是________________;装置乙的作用是________________。
(3)计算溶液中Na2CO3质量分数的计算式为_____________________________________。
(4)若去掉装置甲,测定结果会________;若去掉装置乙,测定结果会________。(填“偏大”“偏小”或“无影响”)。
科目:高中化学 来源: 题型:
| A、室温下在浓硝酸、浓盐酸和浓硫酸中分别投入光亮的铁钉,在盐酸中溶解最快 | B、在氯碱工业中,产物烧碱在阴极区得到,两极气态产物可用于合成盐酸 | C、纯碱可用于生产普通玻璃;硝酸可用于制化肥和炸药等 | D、工业盐酸和工业硝酸都常呈黄色,因所含杂质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届江苏省苏南四校高三12月月考试化学试卷(带解析) 题型:填空题
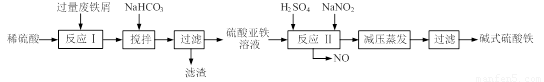
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏南四校高三12月月考试化学试卷(解析版) 题型:填空题
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
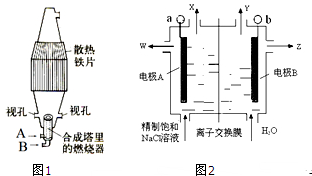
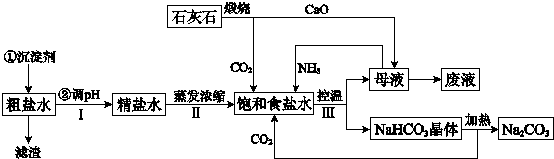
氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
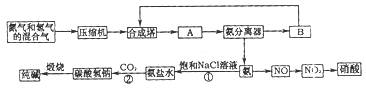
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,为了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:
Na2CO3+2NO2=NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com