
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
分析 A.NaCl为氯化钠的化学式,氯化钠为离子化合物,不存在氯化钠分子;
B.铁与非氧化性酸反应生成亚铁离子,但是与硝酸反应可以生成铁离子;
C.化合价升高值=转移电子数,根据1mol Na转变为Na2O2中的Na+时失去1mol电子结合N=nNA;
D.NO2和N2O4的最简式均为NO2.
解答 解:A.58.5g氯化钠的物质的量为1mol,氯化钠为离子化合物,不存在氯化钠分子,故A错误;
B.1mol铁与盐酸、稀硫酸反应失去2mol电子,但是与足量稀硝酸反应失去3mol电子,故B错误;
C.1molNa转变为Na+时失去1mol电子,即失去的电子数为N=1mol×NA=NA,故C错误;
D.NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含氮原子数即NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,题目难度不大.


科目:高中化学 来源: 题型:推断题
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
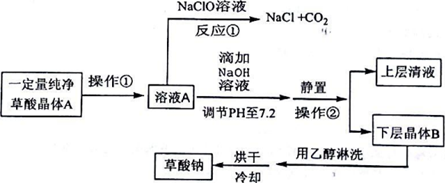
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
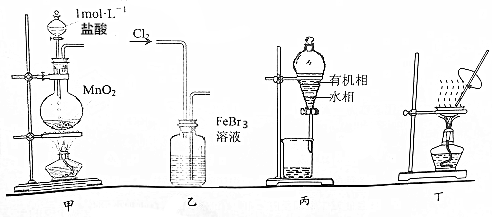
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙氧化FeBr3溶液中的溴离子 | |
| C. | 用装置丙分液时先从下口放出水相,再从上口倒出有机相 | |
| D. | 用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
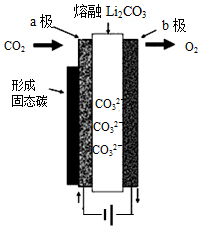 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )| A. | 化学能转变为电能 | |
| B. | 阴极的电极反应为:CO2+4e-=C↓+2O2- | |
| C. | 阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑ | |
| D. | 阴极上每通过4mole-,阴极区有1molCO2参与反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AB2 | B. | A2B | C. | AB3 | D. | A3B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液 | B. | AlCl3溶液 | C. | MgCl2溶液 | D. | BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,80 g SO3所占的体积约为22.4 L | |
| B. | 常温常压下,1.6 gO2和O3混合气体中质子总数为0.8NA | |
| C. | 0.1 mol甲基(-CH3)所含电子数为NA | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com