
| A、SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物 |
| B、Na2O和NH3的水溶液均能导电,故均为电解质 |
| C、Si和SiO2均属于原子晶体 |
| D、Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物 |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| A、标准状况下,2.24L苯中含0.6NA个氢原子 |
| B、22.4LCl2通入水中充分反应,共转移NA个电子 |
| C、1L1mol?L-1氯化铜溶液中Cu2+的数目小于NA |
| D、0.1mol铁在0.1molCl2中充分燃烧,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4molNaCl所含离子数 |
| B、标准状况下5.6L CO2所含原子数 |
| C、1L1 mol?L-1盐酸所含HCl分子数 |
| D、10g氖气所含原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HF | 3.53×10-4 |
| HCN | 5×10-10 |
| H2SO3 | Ka1=1.54×10-2;Ka2=1.02×10-7 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| Mg(OH)2 | 5.61×10-12 |
| MgCO3 | 6.82×10-6 |
| A、酸性:HF>CH3COOH>H2SO3>HCN |
| B、根据溶度积常数(Ksp),甲同学认为除NaCl溶液中少量的MgCl2杂质需要加稍过量的NaOH溶液,而不是Na2CO3溶液;乙同学认为即使在BaSO4悬浊液中加过量的纯碱溶液,BaSO4也不会转化为BaCO3 |
| C、浓度相同的NaCN溶液和HCN的溶液等体积混合,其pH>7,溶液中各离子浓度大小为:c(OH-)>c(H+)>c(Na+)>c(CN-) |
| D、CH3COONH4水溶液显中性,是因为根据电离常数,CH3COO-结合H+与NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+与OH-浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
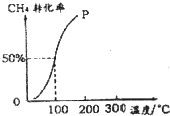 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
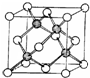 A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com