
| A、40mL 1.5 mol?L-1的 X 溶液 |
| B、20mL 2 mol?L-1的 X 溶液 |
| C、10mL 4 mol?L-1的 X 溶液 |
| D、l0mL 2 mol?L-1的 X 溶液 |


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
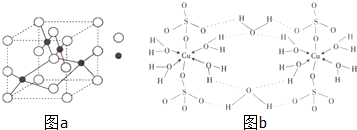
查看答案和解析>>
科目:高中化学 来源: 题型:
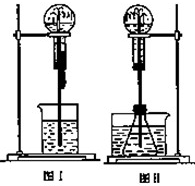 喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.
喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离常数(25℃) |
| HF: Ka1=3.6×10-4 |
| H3PO4: Ka1=7.5×10-3 Ka2=6.2×10-8 Ka3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-→H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:PO43->F->HPO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
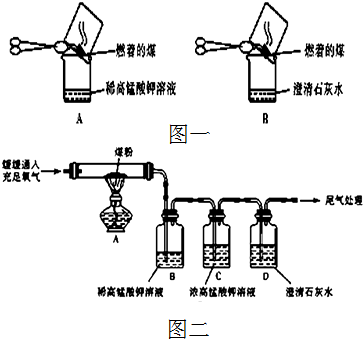
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第Ⅳ族氢化物沸点:CH4<SiH4,则第Ⅴ族氢化物沸点:NH3<PH3 |
| B、第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
| C、可电解熔融氯化镁制取金属镁,则也能用电解熔融氯化铝制取金属铝 |
| D、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| E |
| E |
| X |
| A、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
| B、若D是一种强碱,则A、B、C均可与X反应生成D |
| C、若D为NaCl,且A可与C反应生成B,则E可能是CO2 |
| D、若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com