
| 128g |
| 64g/mol |
| ||
| 20% |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、K+ SO42-,ClO- |
| B、K+.NH4+,Cl- |
| C、Na+,K+,CO32- |
| D、Na+,Fe3+,I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) 浓度(mol?L-1) | 0 | 5 | 10 | 15 | 20 | 25 |
| NO | 1.00 | 0.60 | 0.40 | 0.40 | 0.52 | 0.52 |
| N2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
| CO2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
查看答案和解析>>
科目:高中化学 来源: 题型:
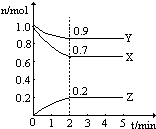 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ||
| B | C |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:
一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量使用合成洗涤剂洗涤衣物 |
| B、大量使用尿素替代碳酸氢铵以提高农作物产量 |
| C、大量使用一次性竹、木筷子以推动林业发展 |
| D、大量利用垃圾生产燃料、肥料“变废为宝” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com