
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象是因为光的反射 |
分析 A.从胶体分散系呈电中性分析;
B.根据胶体聚沉的条件和复分解的条件分析;
C.胶体较稳定,溶液稳定;
D.丁达尔现象是胶体粒子对光线散射形成的.
解答 解:A.溶液呈电中性,胶体分散系不带电,是胶体粒子吸附带电离子,故A错误;
B.胶体加入电解质溶液会发生聚沉可产生沉淀,复分解发生的条件之一是生成沉淀,所以溶液可以生成沉淀,溶液氢氧化钡与硫酸钠反应生成硫酸钡沉淀,故B错误;
C.胶体较稳定,是一种介稳性的分散系,溶液是一种非常稳定的分散系,故C正确;
D.丁达尔现象是胶体粒子对光线散射形成的,可以用于区分胶体和溶液,故D错误;
故选C.
点评 本题考查了胶体和溶液中分散质的组成和性质,题目较简单,注意分析胶粒带电的原因和溶液中溶质的类别.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,甲烷则不能使其褪色 | |
| B. | 溶于水能导电的化合物不一定是离子化合物 | |
| C. | 需要加热的反应不一定是吸热反应 | |
| D. | 石油的分馏和煤的干馏都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
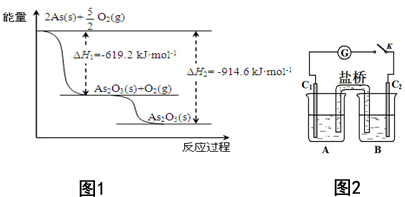 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③② | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1 mol/L氯化钠溶液 | B. | 75mL 2 mol/L氯化镁溶液 | ||
| C. | 50mL 3 mol/L氯化钾溶液 | D. | 50mL 1 mol/L氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片加入FeCl3溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 盐酸中加入Ca CO3:CO32-+2H+═H2O+CO2↑ | |
| C. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
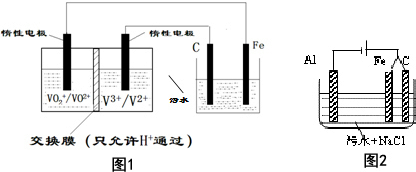
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com