
在恒容密闭容器中,反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0达到平衡后,改变某一条件,下列说法正确的是
CH3OH(g)+H2O(g) △H<0达到平衡后,改变某一条件,下列说法正确的是

A.升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动
B.升高温度,可提高CO2转化率
C.增加H2的浓度,可提高CO2转化率
D.改用高效催化剂,可增大反应的平衡常数
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
如图是元素周期表的一部分,下列关系正确的是( )
| S | Cl |
| Se | Br |
A.还原性:Se2->S2->Cl-
B.热稳定性:HCl>H2Se>HBr
C.原子半径:Se>Cl>S
D.酸性:HBrO4>HClO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢 H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正 确的是( )
确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中曲线变化不正确的是

A.①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示HCl和MgCl2溶液中滴入氨水
D.④表示一定条件下反应:2SO2+O2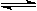 2SO3 ΔH< 0 ,达平衡后,增大压强
2SO3 ΔH< 0 ,达平衡后,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中进行如下反应:
N2+3H2 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
A.平衡不发生移动 B.平衡沿着逆反应方向移动
C.正逆反应速率都增大 D.NH3的质量分数增加

查看答案和解析>>
科目:高中化学 来源: 题型:
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.23 mol SO2和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应
2SO2+O2 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=
______________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度__________(填“增
大”“不变”或“减小”),氧气的转化率________(填“升高”“不变”或“降低”),SO3的体积分数________(填“增
大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH=== 。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为 。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO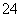 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设。
假设1:只存在SO ;假设2:既不存在SO
;假设2:既不存在SO ,也不存在ClO-;假设3: 。
,也不存在ClO-;假设3: 。
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1 H2SO4、1 mol·L-1NaOH、0.01 mol·L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。

查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g) 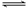 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com