
分析 根据混合物由两种或两种以上不同物质组成的物质;酸是指在电离时产生的阳离子全部是氢离子的化合物;
碱是电离产生的阴离子全部为氢氧根离子的化合物;氧化物是由两种元素组成的且有一种是氧元素的化合物;
盐是由金属离子和酸根离子组成的化合物;有机物是绝大多数含碳化合物;以此解答该题.
解答 解:①空气、⑤碘酒由两种或两种以上不同物质组成的物质组成,为混合物;
③H2O④CaO是两种元素组成其中一种是氧元素的化合物,属于氧化物;
⑦H2SO4电离出的阳离子全部是氢离子,属于酸;
⑧Ca(OH)2电离产生的阴离子全部为氢氧根离子的化合物;
①H2O、③CaO由两种元素组成且其中一种是氧元素,属于氧化物;
⑨CuSO4•5H2O、⑥Na2CO3在溶液中电离出的阳离子为金属离子,阴离子为酸根离子,属于盐,
⑩C2H5OH 是含碳化合物,属于有机物,
故答案为:①⑤;③④;⑦;⑧;⑥⑨;⑩.
点评 本题考查物质的分类知识,题目难度不大,注意把握物质的组成和分类依据以及概念的内涵.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe、FeO和Fe2O3的混合物中加入过量的盐酸 | |
| B. | 等物质的量的 NaHCO3溶液与 Na2O2固体 | |
| C. | 等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液 | |
| D. | 在NaBr溶液中通入过量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
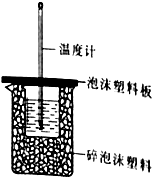 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=z | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com