
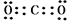 (2)第二周期第ⅥA族
(2)第二周期第ⅥA族 (6) Cl ; b、d
(6) Cl ; b、d

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.碘131的核内质子数是53,核外电子数为78 |
| B.铯是金属性最强的元素,碘是非金属性最强的元素 |
| C.碘元素在自然界有12753I和13153I两种稳定的同位素 |
| D.13755Cs原子核内含有82个中子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

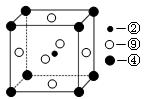


查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
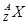 ,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
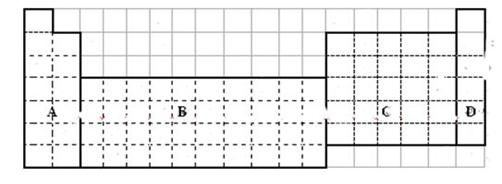
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
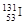 、
、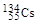 、
、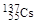 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )A.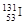 和 和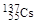 位于同一周期 位于同一周期 |
B.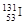 和 和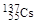 具有相同的中子数 具有相同的中子数 |
C.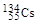 原子半径小于 原子半径小于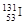 原子半径 原子半径 |
| D.Cs元素最高价氧化物对应的水化物呈强碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①④⑤ | C.②④⑤ | D.②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com