
【题目】某温度时,在一个 2 L 的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应在_____________min 时达到平衡状态。
(2)该反应的化学方程式为___________________________________________。
(3)从开始至 2min,Z 的平均反应速率为____________________________________。
【答案】2 3X+Y2Z 0.05mol/(Lmin)
【解析】
(1)根据反应平衡状态时的特征分析判断;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)根据v=![]() 计算反应速率v(Z)。
计算反应速率v(Z)。
(1)反应平衡状态时体系内各组分的含量保持不变,根据图像可知,当反应进行到2min时反应达到平衡状态;
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y2Z;
(3)在2min时间内,用Z表示反应的平均速率v(Z)=![]() =
= =0.05mol/(Lmin)。
=0.05mol/(Lmin)。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是
A. 气体的平均摩尔质量不变 B. BaO量减小
C. BaO2的转化率减小 D. 体积中密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某反应在体积为4 L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
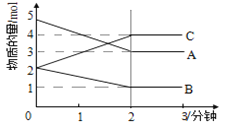
(1)该反应的化学方程式为____________________
(2)反应开始至2分钟时,B的平均反应速率为__________,A的转化率为________________________
(3)能说明该反应已达到平衡状态的是______________
a.容器内气体的颜色保持不变
b.容器内混合气体的密度保持不变
c.v逆(B)= 2v正(C)
d.容器内混合气体的平均相对分子质量不再改变
II.如图是氢氧燃料电池构造示意图。
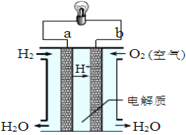
该电池工作时,电子的流向______→_____(填“a”“b”),每生成1 mol H2O则理论上电路中通过的电子数为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体使气囊鼓起。
已知:![]() 。
。
实验室利用如图装置模拟工业级NaN3制备。
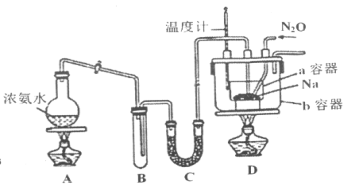
实验Ⅰ:制备NaN3
(1)装置C中盛放的药品为____________,装置B的主要作用是__________________。
(2)为了使a容器均匀受热,装置D中进行油浴而不用水浴的主要原因是______________。
(3)氨气与熔化的钠反应生成NaNH2的化学方程式____________________________________。
(4)N2O可由NH4NO3(熔点169.6℃)在240℃分解制得,应选择的气体发生装置是________。
实验Ⅱ:分离提纯
分离提纯反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。
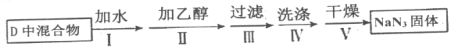
(5)已知:NaNH2能与水反应生成NaOH和氨气,操作Ⅳ采用__________洗涤,其原因是_____________。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液于锥形瓶中,加入50.00mL 0.1010![]() (NH4)2Ce(NO3)6 溶液。
(NH4)2Ce(NO3)6 溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,0.0500![]() (NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗标准溶液的体积为29.00mL。测定过程中涉及的反应方程式如下:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑,Ce4++Fe2+=Ce3++Fe3+
(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗标准溶液的体积为29.00mL。测定过程中涉及的反应方程式如下:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑,Ce4++Fe2+=Ce3++Fe3+
(6)配制叠氮化钠溶液时,除烧杯、玻璃棒、量筒外,还需要用到的玻璃仪器有___________。若其它读数正确,滴定到终点后读取滴定管中(NH4)2Fe(SO4)2标准溶液体积时俯视,将导致所测定样品中叠氮化钠质量分数__________(选填“偏大”、“偏小”或“不变”)。
(7)试样中NaN3的质量分数为___________。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:
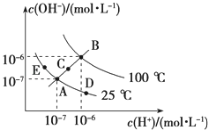
(1)图中五点KW间的关系是__________________.
(2)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=2a,Va<Vb, 则a的取值范围为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
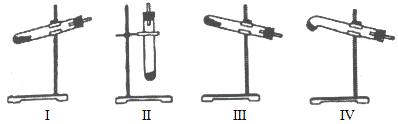
【题目】下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A. 甲装置:可用来证明硫的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法能检查此装置的气密性
D. 丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业和生活中产生的废气![]() 、
、![]() 、
、![]() 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为![]() ;1mol水蒸气变成液态水放热
;1mol水蒸气变成液态水放热![]() :
:![]()
![]() ,则
,则![]()
![]() ____________。
____________。
(2)汽车尾气中含有![]() 和
和![]() ,某研究小组利用反应:2CO(g)+2NO(g)
,某研究小组利用反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的
N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的![]() 和
和![]() ,能自发进行上述反应,测得不同时间的
,能自发进行上述反应,测得不同时间的![]() 和
和![]() 的浓度如表:
的浓度如表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
①0到2s内用![]() 表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
②若该反应在恒容绝热条件下进行,再次达到平衡后的平衡常数为K2,则K1______ K2(填“>”、“<”'或“=”)。
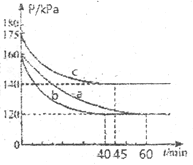
(3)一定条件下,通过下列反应可实现燃煤烟气中硫的回收2CO(g)+SO2(g)![]() S(s)+2CO2(g) △H<0
S(s)+2CO2(g) △H<0
若向![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() 和
和![]() ,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。
,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。
(4)常温下,用![]() 溶液作
溶液作![]() 捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中
捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中![]() ____________。(常温下
____________。(常温下![]() 、
、![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。
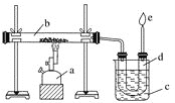
(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,下列说法正确的是( )
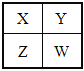
A. 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C. 若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D. 若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com