
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
分析 A.该反应中Fe元素化合价由+2价变为+3价、O元素化合价由-1价变为0价和-2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物;
B.该反应中有4mol过氧化钠反应时有3mol过氧化钠得电子发生还原反应,只有过氧化钠作氧化剂;
C.根据转移电子相等计算;
D.该反应中生成的就是红褐色沉淀.
解答 解:A.该反应中Fe元素化合价由+2价变为+3价、O元素化合价由-1价变为0价和-2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,所以Fe2+和$\frac{1}{4}$的过氧化钠作还原剂,Fe(OH)3是还原产物,故A错误;
B.该反应中有4mol过氧化钠反应时有3mol过氧化钠得电子发生还原反应,有$\frac{3}{4}$的过氧化钠作氧化剂,则4 mol Na2O2在反应中共得到6NA个电子,故B错误;
C.根据转移电子相等得被Fe2+还原的氧化剂的物质的量=$\frac{0.2mol×2}{1}$=0.4mol,故C正确;
D.该反应中有氧气生成,所以不能先生成氢氧化亚铁沉淀,而是直接生成红褐色沉淀,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,明确氧化还原反应基本概念、各个物理量之间的有关计算等知识点是解本题关键,注意过氧化钠部分做氧化剂、部分做还原剂,为易错点.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:实验题
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收10L空气中的CO2(标准状况) | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成聚碳酸酯等可降解塑料,以减少白色污染 | |
| B. | 减少生产、生活中产生的扬尘,以减少雾霾天气的形成 | |
| C. | 加强生活污水的脱氮、除磷处理,以遏制水体的富营养化 | |
| D. | 使用汽车尾气净化器.以减少二氧化碳的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
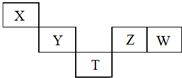 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
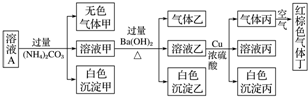
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
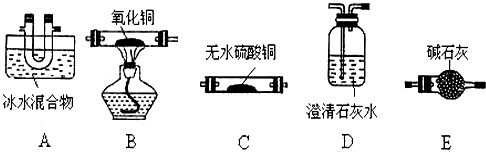
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
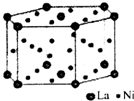 对物质性质的认识源于对其结构的了解.
对物质性质的认识源于对其结构的了解. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
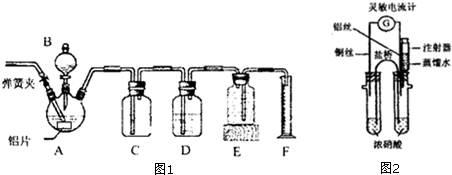
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com