
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 L 1 mol L—1硫酸溶液中所含的氧原子数为4NA
B.标准状况下,11.2 L CC14中所含的原子数为2.5NA
C.2.7 g A1与足量氧气充分反应,转移的电子数为0.3NA
D.常温常压下,14 g由N2与CO组成的混合气体中所含的原子数为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.将30mL0.5mol/LNaOH溶液加水稀释500mL,所得溶液的NaOH的浓度为0.3mol/L
B.配制250mL1.0mol/LH2SO4溶液,需要18mol/L的浓硫酸的体积为13.9mL
C.0.270Kg质量分数为10%的CuCl2溶液中Cl-的物质的量为0.2mol
D.80gNaOH溶于1L水中所得的溶液的物质的量浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22—。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mL)的关系如下图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是
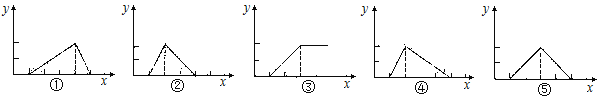
A.③②① B.②③④ C.③⑤④ D.⑤③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中反应物和生成物共有六种物质:HC1(浓)、KMnO4、MnCl2、H2O、Cl2、KCl。已知Cl2、MnCl2为生成物。
(1) 该反应中的氧化剂为____________,氧化产物为________。氧化产物与还原产物的物质的量之比为___________。
(2) 若产生的气体在标准状况下的体积为1.12 L,则反应过程中转移的电子数为_________NA(NA表示阿伏加德罗常数的数值)。
(3) 若反应中转移0.3 mol电子,则消耗(或生成)HC1____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。(杂质发生的电极反应不必写出)请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①写出电解饱和NaCl溶液总的离子方程式 。
②在X极附近观察到的现象是_______________________。检验Y电极反应产物的方法是________________。
(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,则:
①X电极发生的反应类型为 ;②Y电极的材料是_____________,主要电极反应式为_______________。CuSO4溶液的浓度 (填 “不变”“略有增加”或“略有减少”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_______剂,具有 性。在该反应中,若消耗了32gCu,则转移了_______mol 电子 ,生成 L SO2(标准状况)气体。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_______剂,具有 性。在该反应中,若消耗了32gCu,则转移了_______mol 电子 ,生成 L SO2(标准状况)气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)该硫酸的物质的量浓度是____________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。
(3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。

(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。

(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是 。
A.未经冷却趁热将溶液注入容量瓶中 |
B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 |
D.摇匀后发现液面低于刻度线继续加水定容 |
(6)用配制好的4.6 mol/L的稀硫酸溶液,再来配制50ml 1.4mol/L的H2SO4溶液,需要取配好的溶液_______________ml.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com