
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是______。
A.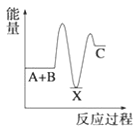 B.
B.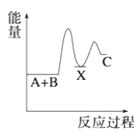
C.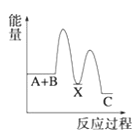 D.
D.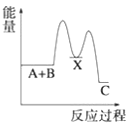
(2)①合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量,已知(见图1):则1molN﹣H键断裂吸收的能量约等于______kJ。

②图2t2时刻改变的条件是______,t3时刻改变的条件是______。
③某温度下,若把10molN2与30molH2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率______。
④绝热恒容条件下,可以作为判断该反应达到平衡状态的依据是_____。
A.容器内气体的总压强保持不变
B.H2、N2的反应速率比为3∶1
C.容器内气体的平均摩尔质量保持不变
D.容器内气体的温度保持不变E.容器内气体的密度保持不变
【答案】D 391 减小压强 升高温度 33.3% ACD
【解析】
(1) A+B→C为放热反应,则A+ B的总能量大于生成C的总能量,所以A、B错误;
A+B→X (吸热),则X的能量大于A+B的总能量, X→C (放热),则X的能量大于C的总能量,所以C错误;故选D;
(2) ①工业合成氨反应为:3H2+N2![]() 2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2 kJ;可以算出N-H键键能为+391kJ;
2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2 kJ;可以算出N-H键键能为+391kJ;
②t2时刻,v正、v逆都减小,说明改变的条件是降温或减压,又因为此时平衡向逆向移动,所以改变的条件只能是减压;
③设N2的浓度为x
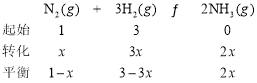
平衡时,混合气体中氨的体积分数为20%,可得:![]() ,解得
,解得![]() ;
;
④A.由于反应前后系数之和不同,压强是变量,压强不变时,反应达到平衡,A正确;
B.由反应系数可知,H2、N2的系数比为3∶1,根据反应速率之比等于系数比,H2、N2的反应速率比一直是3∶1,是定值,不能判断平衡,B错误;
C.容器内气体的平均摩尔质量![]() ,根据质量守恒,m为定值,但n是变量,故M也为变量,可以判定平衡,C正确;
,根据质量守恒,m为定值,但n是变量,故M也为变量,可以判定平衡,C正确;
D.由于正反应放热,随着反应的进行,温度在不断变化,所以温度可用来判定平衡,D正确;
E.容器内气体的密度![]() ,根据质量守恒,m为定值,容器体积固定,V也为定值,故ρ是定值,不能判定平衡,E错误;
,根据质量守恒,m为定值,容器体积固定,V也为定值,故ρ是定值,不能判定平衡,E错误;
故选ACD。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】工业上烟气脱氮的原理![]()
(1)该反应化学平衡常数K的表达式为____________。温度升高,K值___________(选填“增大”、“减小”、“不变”)。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变 b.容器内气体的压强不变
c.反应消耗0.5mol NO的同时生成1mol N2 d.![]() 的浓度不变
的浓度不变
(3)向2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了0.2mol,则用![]() 表示的平均反应速率为__________。
表示的平均反应速率为__________。
(4)如图是P1压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为![]() 下NO的转化率随反应时间变化的示意图。
下NO的转化率随反应时间变化的示意图。
 ______
______
(5)工业合成氨的反应温度选择500℃左右的原因是_______________。
(6)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥![]() 。
。![]() 溶液显__________性;常温下将等体积等浓度的氨水和
溶液显__________性;常温下将等体积等浓度的氨水和![]() 溶液混合,pH>7,溶液中
溶液混合,pH>7,溶液中![]() 浓度由大到小的关系是_______________。
浓度由大到小的关系是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+3Y(g)![]() 2Z(g) △H的能量变化如下图所示。下列说法正确的是
2Z(g) △H的能量变化如下图所示。下列说法正确的是

A. △H= E2- E1 B. 更换高效催化剂,E3不变
C. 恒压下充入一定量的氦气n(Z)减少 D. 压缩容器,c(X)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机化学中有一种“吉利分子”C8H8O8,“吉利分子”C8H8O8可由X经如图所示转化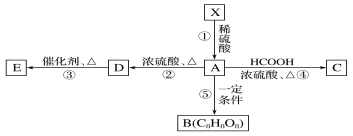
已知:①相同条件下,X与H2的相对密度为81,其中氧的质量分数约为49.4%,分子中氢、氧原子个数比为2∶1,X中没有支链;
②1 mol X在稀硫酸中发生反应生成2 mol甲醇和1 mol A;
③A中含有手性碳原子;
④D能使Br2的CCl4溶液褪色,E为高分子化合物,B为环状结构。
根据上述信息填空:
(1)X的分子式为______,A的分子中含有官能团的名称是______,E的结构简式为______;D若为纯净物,D的核磁共振氢谱存在________种吸收峰,面积比为________。
(2)写出B的一种含一个六元环的同分异构体的结构简式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:_____。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:____;该电池在工作时,A电极的质量将____(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1molH2SO4,则转移电子的数目为_____。
(3)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
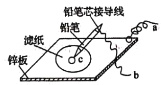
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现______色,铅笔芯c点处的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
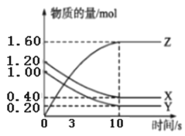
A.该反应的化学方程式为3X+Y![]() 2Z
2Z
B.3s时,正逆反应速率相等
C.平衡时X的浓度为0.40mol/L
D.10s时,该反应达到了最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
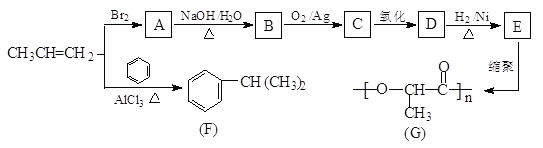
完成下列填空:
(1)F的分子式为_______________,化合物E中所含两个官能团的名称是____、______。
(2)写出反应类型:丙烯直接形成高分子______;A→B____________。
(3)B转化为C的化学方程式为____________。
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1molM与足量的金属钠反应可产生lmolH2,则M的结构简式为____________。
(5)写出由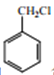 合成
合成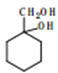 的合成路线________。
的合成路线________。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是___;基态硫原子的价电子排布式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____(填化学式)。1 mol CN-中含有的π键的数目为____。
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是_____;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______(填元素符号)。
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=___g·cm-3(列出计算式即可)。
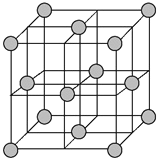
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com