
ЎҫМвДҝЎҝіЈОВПВЈ¬Пт0.1molЎӨL1¶юФӘИхЛбH2AИЬТәЦРјУИлЗвСх»ҜјШ№ММеёДұдИЬТәөДpHЈ¬ИЬТәЦРөДH2AЎўHAЎўA2өДОпЦКөДБҝ·ЦКэ![]() (X)ЛжpHөДұд»ҜИзНјЛщКҫ[ТСЦӘ
(X)ЛжpHөДұд»ҜИзНјЛщКҫ[ТСЦӘ![]() (X) =
(X) =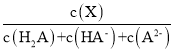 ]ЎЈПВБРРрКцҙнОуөДКЗ
]ЎЈПВБРРрКцҙнОуөДКЗ
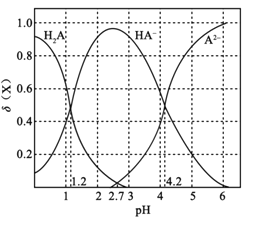
A.pH=1.2КұЈ¬c(K+)+c(H+)=c(H2A)+c(OH)
B.іЈОВПВЈ¬H2AөДөзАлЖҪәвіЈКэKa2=1042
C.pH=2.7КұЈ¬c(HA)Јҫc(H2A)=c(A2)
D.KHAИЬТәЦРАлЧУЕЁ¶ИОӘc(K+)Јҫc(HA)Јҫc(OH)Јҫc(H2A)Јҫc(H+)Јҫc(A2)
Ўҫҙр°ёЎҝD
ЎҫҪвОцЎҝ
AПоЎўУЙНјПсҝЙЦӘЈ¬pH=1.2КұЈ¬¶юФӘИхЛбH2AИЬТәУлЗвСх»ҜјШ№ММе·ҙУҰөГөҪH2A әНKHA»мәПИЬТәЈ¬ИЬТәЦРc(H2A)=c(HA)Ўўc(A2)=0Ј¬УЙИЬТәЦРөДөзәЙКШәг№ШПөc(K+)+c(H+)=c(OH)+c(HA)+2 c(A2)ҝЙөГc(K+)+c(H+)=c(H2A)+c(OH)Ј¬№КAХэИ·Ј»
BПоЎўУЙНјПсҝЙЦӘЈ¬pH=4.2КұЈ¬¶юФӘИхЛбH2AИЬТәУлЗвСх»ҜјШ№ММе·ҙУҰөГөҪK2A әНKHA»мәПИЬТәЈ¬ИЬТәЦРc(H+)=104.2 mol/LЈ¬c(HA)=c(A2)Ј¬ФтH2AөДөзАлЖҪәвіЈКэKa2= 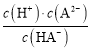 = c(H+)=104.2Ј¬№КBХэИ·Ј»
= c(H+)=104.2Ј¬№КBХэИ·Ј»
CПоЎўУЙНјПсҝЙЦӘЈ¬pH=2.7КұЈ¬¶юФӘИхЛбH2AИЬТәУлЗвСх»ҜјШ№ММе·ҙУҰөГөҪH2A ЎўK2A әНKHA»мәПИЬТәЈ¬ИЬТәЦРc(H2A)=c(A2)Ј¬УЙЧЭЧшұкКэҫЭҝЙЦӘc(HA)Јҫc(H2A)=c(A2)Ј¬№КCХэИ·Ј»
DПоЎўУЙНјПсҝЙЦӘЈ¬KHAИЬТәПФЛбРФЈ¬ИЬТәЦРc(H+)Јҫc(OH)Ј¬ЛөГчИЬТәЦРHAөДөзАлҙуУЪHAөДЛ®ҪвЈ¬ФтИЬТәЦРc(A2)Јҫc(H2A)Ј¬№КDҙнОуЈ»
№КСЎDЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪЛ®ИЬТәЦРЈ¬ПВБРөзАл·ҪіМКҪХэИ·өДКЗ(ЎЎЎЎ)
A.CaCl2===Ca2Ј«Ј«Cl2B.Na2SO4=== NaЈ«Ј«![]()
C.HNO3=== HЈ«Ј«![]() D.NaHCO3===NaЈ«Ј«HЈ«Ј«
D.NaHCO3===NaЈ«Ј«HЈ«Ј«![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТ»¶ЁМхјюПВЈ¬ФЪТ»ёцМе»эҝЙұдөДГЬұХИЭЖчЦРідИл2 molөДЖшМеAәН1 molөДЖшМеB·ўЙъ·ҙУҰЈә2A(g)Ј«B(g)![]() 3C(g)ЎЎҰӨH>0ЎЈt1КұҝМ·ҙУҰҙпөҪЖҪәвЈ¬ІўІвөГCФЪИЭЖчЦРөДМе»э·ЦКэОӘҰХ1ЎЈt2КұҝМёДұдДіТ»Мхјю(ЖдЛыМхјюІ»ұд)Ј¬CФЪИЭЖчЦРөДМе»э·ЦКэөДұд»ҜИзНјЛщКҫЈ¬Фтt2КұҝМёДұдөДМхјюКЗ(ЎЎЎЎ)
3C(g)ЎЎҰӨH>0ЎЈt1КұҝМ·ҙУҰҙпөҪЖҪәвЈ¬ІўІвөГCФЪИЭЖчЦРөДМе»э·ЦКэОӘҰХ1ЎЈt2КұҝМёДұдДіТ»Мхјю(ЖдЛыМхјюІ»ұд)Ј¬CФЪИЭЖчЦРөДМе»э·ЦКэөДұд»ҜИзНјЛщКҫЈ¬Фтt2КұҝМёДұдөДМхјюКЗ(ЎЎЎЎ)

A. јУИл1 molәӨЖш
B. јУИл1 mol B
C. ФцҙуС№Зҝ
D. ЙэёЯОВ¶И
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝНРЕММмЖҪЎўИЭБҝЖҝЎўБҝНІКЗіЈјыөДЦРС§»ҜС§јЖБҝТЗЖчЈ¬КмЦӘХвР©ТЗЖчөДК№УГКЗ¶ЁБҝСРҫҝ»ҜС§өД»щҙЎЎЈ
(1)ПВБРІЩЧчЦРЈ¬ИЭБҝЖҝЛщІ»ҫЯұёөД№ҰДЬУР________________ (МоРтәЕ)ЎЈ
A.ЕдЦЖТ»¶ЁМе»эЧјИ·ЕЁ¶ИөДұкЧјИЬТә B.ЦьҙжИЬТә C.ІвБҝИЭБҝЖҝ№жёсТФПВөДИОТвМе»эөДИЬТә D.ЧјИ·ПЎКНДіТ»ЕЁ¶ИөДИЬТә E.БҝИЎТ»¶ЁМе»эөДТәМе F.УГАҙјУИИИЬҪв№ММеИЬЦК
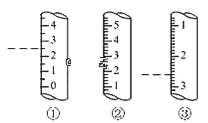
(2)ИзНјКЗДіР©ТЗЖчөДҝМ¶ИІҝ·ЦКҫТвНјЈ¬НјЦРёчТЗЖчРйПЯОӘЛщКҫ¶БКэЎЈЖдЦРОӘБҝНІөДКЗ_______ (МоұаәЕ)Ј¬¶БКэОӘ_____mLЎЈ
(3)КөСйКТУГ98%өДЕЁБтЛбЕдЦЖ(ЕЁБтЛбөДГЬ1.84g/mL)450mL 0.1 molЎӨL-1өДБтЛбЎЈ»ШҙрПВБРОКМвЈә
ўЩЕдЦЖЦРУҰСЎУГөДІЈБ§ТЗЖчіэБҝНІЎўЙХұӯЎўІЈБ§°фЎў»№УР___________Ј¬УҰБҝИЎ________mL 98%өДЕЁБтЛбЎЈ
ўЪ¶ФЕЁБтЛбПЎКН№эіМЦРУцөҪПВБРЗйҝцЈ¬К№ЛщЕдЦЖөДБтЛбЕЁ¶ИҙуУЪ0.1mol/LУР_____(МоРтәЕ)
A.ОҙҫӯАдИҙіГИИҪ«ИЬТәЧўИлИЭБҝЖҝЦР
B.ТЎФИәу·ўПЦТәГжөНУЪҝМ¶ИПЯЈ¬ФЩјУЛ®ЦБҝМ¶ИПЯ
C.ИЭБҝЖҝЦРФӯУРЙЩБҝХфБуЛ®
D.¶ЁИЭКұё©КУ№ЫІмТәГж
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР№ШУЪ·ҙУҰЧФ·ўРФөДЛө·ЁХэИ·өДКЗ
A. ЎчHЈј0ЎўЎчSЈҫ0өД·ҙУҰЈ¬УРАыУЪЧФ·ўҪшРР
B. »ҜәП·ҙУҰ¶јКЗ·ЕИИ·ҙУҰЈ¬·ЦҪв·ҙУҰ¶јКЗОьИИ·ҙУҰ
C. ·ІКЗ·ЕИИ·ҙУҰ¶јКЗЧФ·ўөДЈ¬ОьИИ·ҙУҰ¶јКЗ·ЗЧФ·ўөД
D. ЧФ·ў·ҙУҰФЪИОәОМхјюПВ¶јДЬЧФ¶ҜҪшРРЈ¬ПЦПуГчПФ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»ҜС§ЙПіЈУГAGұнКҫИЬТәөДЛбјо¶ИЈ¬AG=![]() ЎЈ25ЎжЈ¬УГ0.100molЎӨL-1NaOHТәөО¶Ё20.00 mL 0.100 molЎӨL-1 HNO2ИЬТәЈ¬ AGУлЛщјУNaOHИЬТәөДМе»э(V)№ШПөИзНјЛщКҫЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
ЎЈ25ЎжЈ¬УГ0.100molЎӨL-1NaOHТәөО¶Ё20.00 mL 0.100 molЎӨL-1 HNO2ИЬТәЈ¬ AGУлЛщјУNaOHИЬТәөДМе»э(V)№ШПөИзНјЛщКҫЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
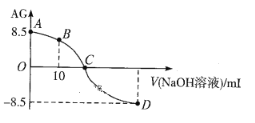
A. DөгИЬТәЦРөДpH=11.25
B. BөгИЬТәЦРҙжФЪ2c(H+)Јӯ2c(OH-)=c(NO2-)Јӯc(HNO2)
C. CөгКұЈ¬јУИлNaOHИЬТәөДМе»эРЎУЪ20.00 mL
D. 25ЎжКұЈ¬HNO2өДөзАлЖҪәвіЈКэKa=1.0ЎБ10-5.5
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЙиNAОӘ°ў·ьјУөВВЮіЈКэөДЦөЈ¬ПВБРУР№ШЛө·ЁХэИ·өДКЗ
A.іЈОВіЈС№ПВЈ¬1.8gјЧ»щЈЁЎӘCD3Ј©ЦРә¬УРөДөзЧУКэОӘNA
B.0. lmol»·СхТТНйЈЁ![]() Ј©ЦРә¬УРөД№ІјЫјьКэОӘ0. 3 NA
Ј©ЦРә¬УРөД№ІјЫјьКэОӘ0. 3 NA
C.іЈОВПВЈ¬1L pH=9өДCH3COONaИЬТәЦРЈ¬·ўЙъөзАлөДЛ®·ЦЧУКэОӘ1ЎБ10Јӯ9 NA
D.јУИИМхјюПВЈ¬ә¬0.2molH2SO4өДЕЁБтЛбУлЧгБҝНӯ·ҙУҰЈ¬ЧӘТЖөзЧУКэРЎУЪ0.2NA
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪ3ёцМе»эҫщОӘ4.0 LөДәгИЭГЬұХИЭЖчЦРЈ¬·ҙУҰ CO2(g)Ј«C(s)![]() 2CO(g) ҰӨH > 0Ј¬·ЦұрФЪТ»¶ЁОВ¶ИПВҙпөҪ»ҜС§ЖҪәвЧҙМ¬ЎЈПВБРЛө·ЁХэИ·өДКЗ
2CO(g) ҰӨH > 0Ј¬·ЦұрФЪТ»¶ЁОВ¶ИПВҙпөҪ»ҜС§ЖҪәвЧҙМ¬ЎЈПВБРЛө·ЁХэИ·өДКЗ
ИЭЖч | ОВ¶И/K | ЖрКјКұОпЦКөДБҝ/mol | ЖҪәвКұОпЦКөДБҝ/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.56 | 1.12 | 0 | 0.8 |
II | 977 | 1.12 | 1.12 | 0 | x |
III | 1250 | 0 | 0 | 1.12 | y |
A.977 KЈ¬ёГ·ҙУҰөД»ҜС§ЖҪәвіЈКэЦөОӘ4
B.ҙпөҪЖҪәвКұЈ¬ПтИЭЖчIЦРФцјУCөДБҝЈ¬ЖҪәвХэПтТЖ¶Ҝ
C.ҙпөҪЖҪәвКұЈ¬ИЭЖчIЦРCO2өДЧӘ»ҜВКұИИЭЖчIIЦРөДҙу
D.ҙпөҪЖҪәвКұЈ¬ИЭЖчIIIЦРөДCOөДЧӘ»ҜВКҙуУЪ28.6%
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝNAОӘ°ў·ьјУөВВЮіЈКэөДЦөЎЈПВБРЛө·ЁХэИ·өДКЗ
A.0.1mol14CЦРә¬УРөДЦРЧУКэОӘ0.8NA
B.4.6gC2H5OHЦРә¬УРөД№ІјЫјьКэДҝОӘ0.7NA
C.24gO3Ул11.2LO2Лщә¬өД·ЦЧУКэҫщОӘ0.5NA
D.іЈОВПВpH=3өДҙЧЛбИЬТәЦРЈ¬OHЈӯКэДҝОӘ10Јӯ11NA
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com