
| A. | 硅酸钠溶液就是建筑行业中常用的黏合剂“水玻璃” | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 粗硅制备单晶硅不涉及氧化还原反应 |
分析 A、根据水玻璃的用途来分析;
B、二氧化硅和盐酸不反应;
C、根据水晶项链和餐桌上的瓷盘的成分来分析;
D、根据粗硅制备单晶硅的反应方程式判断化合价是否变化.
解答 解:A、硅酸钠的水溶液俗称水玻璃,水玻璃具有黏合性,可做建筑行业中黏合剂,故A正确;
B、二氧化硅是酸性氧化物,和绝大多数酸不反应,但能和氢氟酸反应,所以工艺师利用氢氟酸刻蚀石英制作艺术品,故B错误;
C、水晶的主要成分是二氧化硅,含有硅元素,但不是硅酸盐,餐桌上的瓷盘是硅酸盐制品,故C错误;
D、粗硅制备单晶硅先利用氧化反应即用Cl2氧化粗硅为SiCl4,再利用还原反应即用H2还原SiCl4,故D错误;
故选A.
点评 本题比较简单,考查的是一些基础知识,注意硅和二氧化硅的性质、用途来分析.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1mol/L•min | B. | 1.5mol/L•min | C. | 0.5mol/L•min | D. | 3mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2 CH2 | B. | CS2分子的结构式:S═C═S | ||
| C. | 醛基的结构简式:-CHO | D. | 羟基的电子式:${\;}_{\;}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .写出A与溴水的反应方程式
.写出A与溴水的反应方程式 +3Br2→
+3Br2→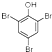 ↓+3HBr
↓+3HBr 或
或 (任写一个).
(任写一个). .
. 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 标准状况下,54g H2O中含有分子数为3NA个 | |
| D. | 0.1mol/L的MgCl2溶液中Cl-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②⑥ | C. | ①⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com