
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ba2+、HCO3-、NH4+、NO3- | ||
| C. | K+、Cu2+、Cl-、OH- | D. | Na+、CO32-、SO42-、K+ |
分析 A.加入硫酸后有BaSO4沉淀生成,但无气体放出;
B.四种离子之间能够共存,加入硫酸后,生成硫酸钡沉淀,放出CO2气体;
C.铁离子与氢氧根离子反应生成难溶物氢氧化铜;
D.加入硫酸后放出CO2气体,但无沉淀生成.
解答 解:A.Ba2+、NO3-、NH4+、Cl-之间不发生反应,但是加入硫酸后有BaSO4沉淀生成,但无气体放出,不满足条件,故A错误;
B.Ba2+、HCO3-、NH4+、NO3-之间不发生反应,加入硫酸后,生成硫酸钡沉淀,放出CO2气体,满足条件,故B正确;
C.OH-与Cu2+会结合生成Cu(OH)2沉淀,不能共存,故C错误;
D.Na+、CO32-、SO42-、K+之间不反应,加入硫酸后放出CO2气体,但无沉淀生成,不满足条件,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.


科目:高中化学 来源: 题型:解答题
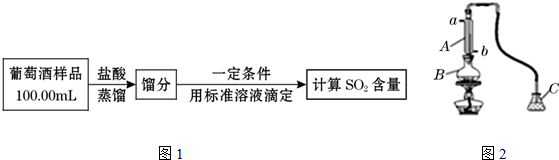
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物 | |
| B. | 在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物 | |
| C. | 在H2O跟ICl的反应中,ICl 既是氧化剂又是还原剂 | |
| D. | 在H2O跟ICl的反应中,ICl是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{5}{3}$X<P<$\frac{17}{9}$X | B. | P=X+$\frac{V•C}{12.5}$ | C. | Y=X+V•C | D. | C=$\frac{1000B}{11.2V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 黑火药的使用 | D. | 打磨磁石制指南针 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
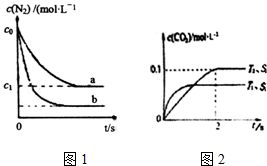 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com