
分析 (1)一水合氨是一元弱碱,部分电离;一水合氨与稀硫酸反应生成(NH4)2SO4;
(2)先根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,再根据c=$\frac{n}{V}$计算所得溶液的物质的量浓度;
(3)根据反应中元素化合价的变化分析;氯气中氯元素从0价降低到-1价,1molCl2转移2mol电子.
解答 解:(1)一水合氨是一元弱碱,部分电离,其电离方程式为:NH3•H2O?NH4++OH-;一水合氨与稀硫酸反应生成(NH4)2SO4,
故答案为:NH3•H2O?NH4++OH-;(NH4)2SO4;
(2)标准状况下,将 2.24L的氨气溶于水配成 0.5L溶液,则n(NH3)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则所得溶液的物质的量浓度为:c=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2;
(3)氨可与Cl2反应,反应方程式如下:8NH3+3Cl2═6NH4Cl+N2,反应中N元素化合价升高,则氨气为还原剂,氯气中氯元素的化合价降低,氯气为氧化剂;氯气中氯元素从0价降低到-1价,1molCl2转移2mol电子,所以1.5mol氧化剂氯气参与反应,则发生转移的电子的物质的量为3mol;当8molNH3参加反应时有2mol被氧化,转移电子为6mol,所以转移3mol电子时,被氧化的氨气为1mol,
故答案为:NH3;3;1.
点评 本题考查较为综合,涉及电离方程式书写、氧化还原反应的计算、物质的量浓度的计算等知识,题目难度中等,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 3 Cl2+6 FeI2═2FeCl3+4 FeI3 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6 HCl═2CoCl2+Cl2↑+3H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
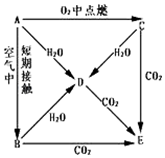 A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
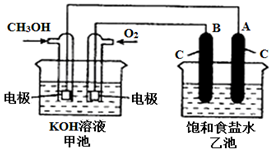 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al(OH)3 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com