
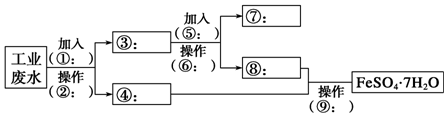
分析 工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,加入①为铁粉,可置换出铜,同时生成硫酸亚铁,操作②为过滤,则滤液④中主要含硫酸亚铁,③中含Cu、Fe,加入⑤为H2SO4,操作⑥为过滤,得到⑦为Cu,⑧中主要含FeSO4,操作⑨为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,以此来解答.
解答 解:(1)由上述分析可知,操作②的名称为过滤;所需要的玻璃仪器为漏斗、玻璃棒、烧杯,
故答案为:过滤;漏斗;玻璃棒;
(2)由上述分析可知,试剂⑤的化学式为H2SO4;所发生的化学方程式为Fe+H2SO4=FeSO4+H2↑,
故答案为:H2SO4;Fe+H2SO4=FeSO4+H2↑.
点评 本题考查混合物的分离、提纯,为高频考点和常见题型,侧重分离流程和废水处理的考查,把握流程中发生的化学反应及分离方法为解答的关键,注重元素化合物与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
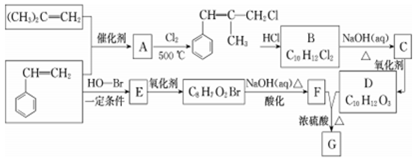
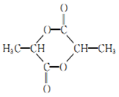
 .G的结构简式为
.G的结构简式为 .
.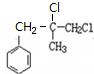 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$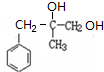 +2NaCl.
+2NaCl.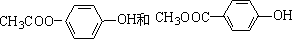 .
. 的合成路线:
的合成路线: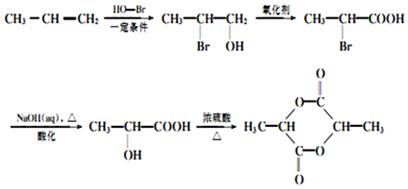 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④①⑧⑦⑤⑥ | B. | ②③④①⑧⑦⑥⑤ | C. | ②①③④⑧⑦⑥⑤ | D. | ②③④⑧①⑦⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子是化学变化中最小的粒子 | |
| B. | 一切原子的原子核都是由质子、中子构成的 | |
| C. | 分子的质量总比原子质量大 | |
| D. | 分子、原子、离子都能直接构成物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用萃取的方法,并选用酒精作萃取剂 | |
| B. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯中 | |
| D. | 从分液漏斗中分离出的就是纯净的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
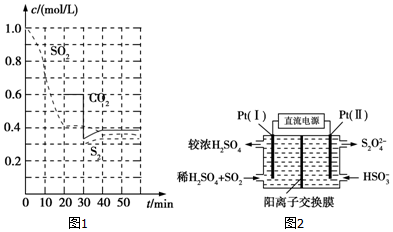
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、Cu2+、NH4+、Cl- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com