
(12分)【化学——化学与技术】
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是 (填“物理变化” 或“化学变化”)。
(2)利用海水晒盐的原理是 ;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于 。
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。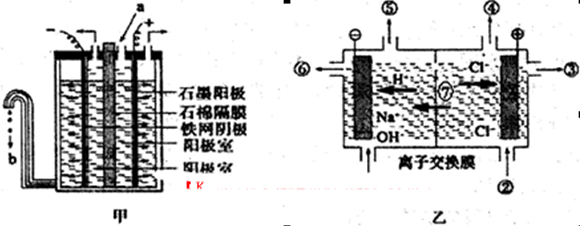
①写出两电极的反应式:阳极 ,阴极 。
②石棉隔膜的作用是 。离子交换膜电解槽中⑥、⑦分别是 、 。
(1)物理变化(1分)
(2)蒸发、结晶 (1分) 工业上冶炼金属钾和镁(2分)
(3)①2Cl--2e-=Cl2↑(2分) 2H++2e- =H2↑(2分)
② 分成阴、阳两极室,阻止气体通过(2分) NaOH溶液(1分) Na+(1分)
解析试题分析:(1)海水变成蒸汽,蒸汽经过冷却而得高纯度淡水为物质状态的变化,没有生成新物质,所以多级闪蒸法是物理变化。
(2)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使氯化钠成晶体析出;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用电解法冶炼金属钾和镁。
(3)①用惰性电极电解饱和食盐水时, Cl-的放电能力强于OH-,阳极氯离子失去电子,发生氧化反应,电极方程式为:2Cl--2e-═Cl2↑,阴极是氢离子放电生成氢气,阴极发生反应的电极方程式为:2H++2e-═H2↑
②如果Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,为了防止Cl2和NaOH反应,石棉隔膜的作用是分成阴、阳两极室,阻止气体通过;电解饱和食盐水时电解槽离子膜,允许阳离子和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+。
考点:本题考查海水的淡化、海水的利用、氯碱工业。


科目:高中化学 来源: 题型:单选题
X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸银溶液中,Y表面有Z析出。其活泼顺序是
| A.X>Y>Z | B.Z>Y>X | C.X>Z>Y | D.Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)某课外活动小组用下图进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为 ;
(2)若开始时开关K与b连接,则B极的电极反应式为 ;
总反应的离子方程式为 ;
(3)当开关K与b连接时,下列说法正确的是(填序号) 。
①溶液中Na+向B极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加入适量的盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移了0.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1991年我国首创以铝-空气-海水为能源的新型“海水电池”,该电池以海水为电解质溶液,靠空气中的氧使铝不断氧化而产生电流。它比干电池能量高20~50倍。其总反应式表示为:4Al+3O2+6H2O===4Al(OH)3。
(1)该电源的负极材料为 ,(2)写出正极反应式为 : 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1,若所盛溶液为CuSO4溶液:则A为 极, A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是 ,Na+移向 极(填A、B)
②B电极上的电极反应式为 ,
总反应化学方程式是 。
③反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。[ pH=-lgc(H+) ]
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)Li-SOC12电池可用于心脏起搏器,该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOC12  4LiCl +S+SO2。
4LiCl +S+SO2。
请回答下列问题:
(1)电池的负极材料为_________,发生的电极反应为____________________;
(2) SOCl2易挥发,实验室中常用NaOH溶液吸收SOC12,如果把少量水滴到SOCl2中,反应的化学方程式为__________________________________________;
(3)用此蓄电池电解含有0.1 mol/LCuSO4和0.1 mol/LNaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是______L,将电解后的溶液加水稀释至1L,此时溶液的pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。



试回答:
(1)B装置中Cu电极上的电极反应式为 ,D装置中Fe电极上的电极反应式为 。
(2)D装置中的实验现象有 ,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为 。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是 (填B或C)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2S 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题(不考虑氢、氧的氧化还原):
放电时,正极的电极反应是 ;电解液中H2SO4的浓度将变 ;当外电路通过1 mol电子时,理论上负极板的质量增加 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com